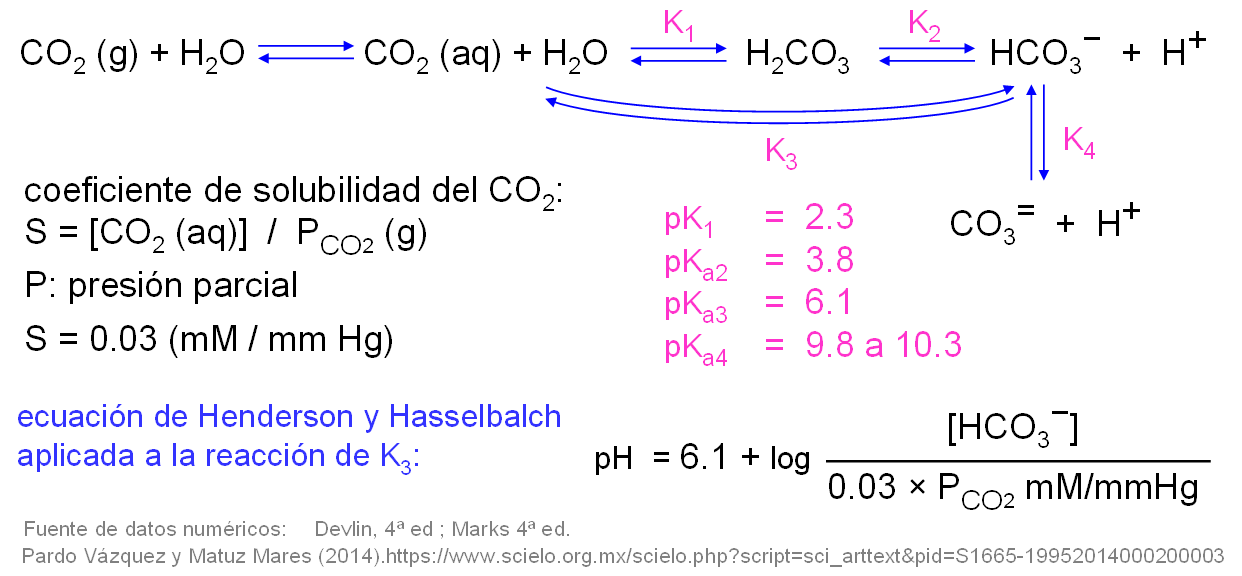

Las determinaciones del analizador hematológico sobre el plasma de un paciente proporcionan estos valores: [HCO3−] = 20.0 mM; [CO2] disuelto = 1.60 mM. ¿Estamos ante una situación de acidosis o de alcalosis?
Un paciente presenta una presión parcial de CO2 en los alveolos pulmonares de 43 mmHg y un pH del plasma sanguíneo de 7.47. Calcula la concentración de bicarbonato en el plasma.
Tu respuesta: [HCO3−] = mM (tolerancia 0.5%)
Dentro de una célula el pH es 7.1 y la concentración total de fosfato es 75 mM. Calcula cuánto fosfato está en la forma HPO4−2 teniendo en cuenta que la constante de acidez del H2PO4− tiene un valor de pKa = 7.2.
Tu respuesta: [HPO4−2] = mM (tolerancia 0.5%) Autoevaluación reparada
Se puede medir la cantidad total de carbonato, bicarbonato y CO2(ac) de una muestra añadiendo suficiente cantidad de un ácido fuerte para que se desplacen los equilibrios y todo se convierta en CO2 volátil, que se puede cuantificar midiendo la presión parcial que genera.
Tenemos 5 mL de plasma sanguíneo, con un pH=7.40.
Se mide el CO2 total obtenido mediante su liberación con ácido, con un resultado de 155 µmol.
Calcula las concentraciones de CO2 y bicarbonato en el plasma de partida.
Tu respuesta: [CO2] = mM [HCO3−] = mM (tolerancia 0.5%)
El pH de una muestra de sangre arterial es de 7.15. Se toman 10 mL y se añade ácido fuerte, lo que libera 5.91 mL de CO2(g).
Calcula: a) la concentración total
de CO2 + bicarbonato en sangre;
b) las concentraciones de CO2(ac) y de HCO3− disueltos en la sangre;
c) la presión
parcial del CO2 en mm Hg.
Dato adicional: 1 mmol de CO2(g) ocupa un volumen de 21.81 mL
Tu respuesta: (tolerancia 0.5%)
a) CT = mM
b) [CO2(ac)] = mM
[HCO3−2] = mM
c) PCO2 = mm Hg