Tema 4 - Estructura de las proteínas (I)
Estructura primaria: enlace peptídico + secuencia
Cap. 7: pp. 100-101 y Biomodel-1 > Proteínas
- Las proteínas son polímeros de aminoácidos, macromoléculas, biopolímeros
- Seguiremos guión y contenidos de Biomodel-1.
- Enlace peptídico
- química
- características y su relevancia para la proteína
- Terminología:
- estructura primaria - definición - animación en Biomodel
- secuencia - definición, representación: sentido y abreviaturas
- residuos
- Ejemplos de péptidos con actividad biológica: angiotensina, glutatión
y de proteínas pequeñas: insulina Cap. 6: pp. 81-82
(opcional) Ilustración comparada de insulina y proinsulina con modelos 3D

- Contribución de los aminoácidos a la carga y punto isoeléctrico de una proteína, así como a su polaridad.
Estructura secundaria: concepto y tipos
Cap. 7: pp. 102-104 y Biomodel-1 > Proteínas
- Definición de estructura secundaria:
- Plegamiento local de la cadena en el espacio.
- Patrones de plegamiento regulares y repetitivos.
- Presentes en todas las proteínas.
- Estabilizada por enlaces no covalentes (principalmente enlaces de H)
- Limitaciones debidas a la rigidez del enlace peptídico: presentación animada (basta sólo con algunas de las pantallas)
(No estudiamos en esta asignatura la parte de la representación de Ramachandran)
También con más detalle en 
- Tipos de estructura secundaria: (seguimos guión y contenidos de Biomodel-1)
- hélice alfa
- hebra beta
- hojas o láminas beta (paralelas y antiparalelas)
- giros
- cortos, rígidos; fuerzan pliegue brusco
- conexión entre tramos de secundaria
- estructura típica
- giros beta: (p.ej., entre hebras en hojas beta antiparalelas)
- bucles o “lazos”
- flexibles, más largos
- no hay estructura fija
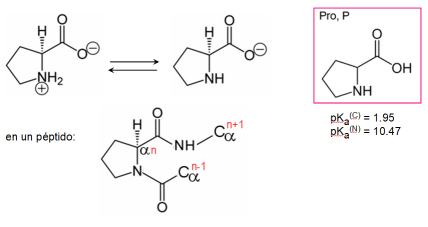
- Singularidad de la prolina:
- único α-iminoácido
- fuerza un giro rígido de la cadena polipeptídica, incompatible con hélice alfa y hebra beta
Estructuras supersecundarias
(En Biomodel-1, pero lo veremos mejor con la estructura terciaria, tema 5)
-fin-
