Tema 5 - Estructura de las proteínas (II)
Reordenación de apartados:
Estructura terciaria. Fuerzas que estabilizan la estructura tridimensional de las proteínas. Plegamiento, desnaturalización y renaturalización.
Estructuras supersecundarias.
Estructura cuaternaria de las proteínas.
Proteínas fibrosas: colágeno, elastina y queratinas. Proteínas globulares. Proteínas plasmáticas e inmunoglobulinas.
+ Introducción a técnicas de estudio de las biomoléculas: electroforesis y cromatografía
Estructura terciaria. Fuerzas que estabilizan la estructura tridimensional de las proteínas. Plegamiento, desnaturalización y renaturalización.
Cap. 7: pp. 101, 104, 106, 114-116.
y Biomodel-1 > Proteínas > Terciaria (apartados esenciales: Estructura terciaria | Estructuras supersecundarias | Efecto hidrófobo)
Concepto de estructura terciaria.
¿Qué estabiliza la estructura 3D?
- Afectan a la secundaria, terciaria y cuaternaria
- Fuerzas débiles, “enlaces débiles”, no covalentes (casi todos), débiles pero muy numerosos Descripción más detallada en cap. 3.2, pp.64-66
- Enlaces de hidrógeno o “puentes” de hidrógeno
- Fuerzas electrostáticas = enlaces iónicos = “puentes salinos”
- Fuerzas de Van der Waals (contacto) y otras interacciones electrostáticas débiles: � ion-dipolo, dipolo-dipolo, catión-pi
- Hidrofobia (polaridad) = aislamiento o “exclusión” del agua, falta de interacción - animación en Biomodel
- El efecto hidrófobo es la fuerza principal que determina el plegamiento de las proteínas.
- Los residuos aminoácidos menos polares (hidrófobos) se colocan preferentemente al interior.
Los polares (hidrófilos) al exterior, en contacto con el agua.
- Esto permite aumentar la entropía del agua, lo que favorece termodinámicamente el sistema
- Ilustración del efecto hidrófobo, sobre la lisozima, en Biomodel-1.
- Explicación en Universidad de La Laguna
- Enlaces o “puentes” disulfuro (*covalentes) y algunos otros, p.ej. en el colágeno.
Complemento para profundizar en las interacciones no covalentes:  (páginas de la Universidad de La Laguna)
(páginas de la Universidad de La Laguna)
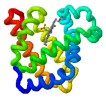
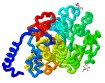
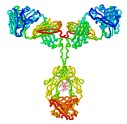
Ejemplos de estructura terciaria (y cuaternaria)
- proteínas solubles
- proteínas de membrana
Estructuras supersecundarias, motivos estructurales y dominios
Biomodel-1 > Proteínas > Estructuras supersecundarias (Opcional: refuerzo en Cap. 5, pp.131-133)
(Son componentes de la estructura terciaria.)
Estructura supersecundaria: agrupación en el espacio de varios tramos de estructura secundaria, habitualmente correlativos en la primaria, dispuestos siempre de una misma forma en el espacio debido a interacciones débiles entre ellos. Aparecen recurrentemente en proteínas diferentes. Se pueden considerar un nivel de organización intermedio entre la secundaria y la terciaria.
Motivo estructural: plegamiento de una parte de la proteína que se repite en otras muchas, relacionado con una función común; típicamente coincide con una estructura supersecundaria.
Dominio: plegamiento tridimensional de una parte importante de una proteína, que adquiere su estructura compacta y globular de modo independiente del resto de la proteína. Normalmente una proteína tendrá 2 o 3 dominios como máximo, cada uno con su estructura terciaria y con una conexión flexible con el resto. Sin cumplir este requisito, se habla a veces de dominios para regiones asociadas a una función o una interacción con otra molécula.
Plegamiento de las proteínas
Cap.7: pp.114-116
- Concepto fundamental en bioquímica / biología estructural:
Una proteína tiene una sola estructura más estable, siempre la misma: estructura nativa. Una secuencia determina una estructura terciaria.
- 1D => 3D una secuencia ==> una estructura nativa
- Interesante su predicción, pero muy difícil
- Polaridad y plegamiento
- Espontáneo, si son pequeñas
- En general, asistido por otras proteínas especializadas (carabinas moleculares)
- Se suele estudiar a la inversa, desplegando (desnaturalización)
- Condiciones desnaturalizantes: ¿qué provoca la desnaturalización? (en el laboratorio, principalmente)
- Todo aquello que altere las fuerzas estabilizantes:
- Cambios de pH. Nota: precipitación en el pI
- Disolventes menos polares. Nota: desnaturalización por etanol
- Detergentes: SDS (dodecilsulfato sódico, laurilsulfato sódico), Triton-X100, Tween-20...
- Urea, guanidinio
- Cambios de fuerza iónica (concentración de sales)
- Cambios de temperatura
- Acción mecánica (agitación, trituración)
Estructura cuaternaria (asociación)
Cap.7: pp. 107-108 y Biomodel-1 > Proteínas
- Asociación de varias cadenas, varias “subunidades”, multimolecular no covalente, en general
- espontánea
- asociada a la función
- a veces covalentes (“entrecruzamientos”): disulfuro o de otros tipos (ejemplos específicos)
- Homo- o heterómeros
- homodímero, heterodímero, heterotetrámero
- Ejemplos
- hemoglobina α2β2
- inmunoglobulina IgG: H2L2
- fosforilasa del glucógeno: A2
- proteínas G: αβγ
- RNA polimerasa (E. coli): αIβ’βαIIωσ
- tropocolágeno: A3
- fibrinógeno: (αβγ)2
Proteínas fibrosas: colágeno, elastina y queratinas
- Estructuras alargadas
- Estructura secundaria: sí, repetitiva
- Estructura terciaria: no se considera
- Estructura cuaternaria: sí
- Se agregan formando fibras
- Generalmente poco solubles
- Función estructural: resistencia mecánica
- Queratinas: pelo, lana, uñas, piel
- Colágeno: tejido conectivo / conjuntivo; matriz extracelular; soporte de órganos; piel, hueso, tendones, córnea
- Elastina: tejido conectivo
- Fibrinógeno y fibrina: soporte de los coágulos
- Tropomiosina: músculo
Queratinas
Fig. 10.18 en p.179 .
- Queratinas α en pelo, lana, uñas, piel
- Sucesivas agrupaciones de proteína en hélice alfa forman fibras.
Colágeno
Cap. 49: pp. 939-941 .
Proteína mayoritaria (en masa) en vertebrados
- Estructura secundaria propia: “hélice del colágeno”; 3 residuos / vuelta, hacia la izquierda
- Composición singular Gly, Pro, Hyp mayoritarios
- Aminoácidos modificados: hidroxiprolina, hidroxilisina. La hidroxilación requiere ascorbato (vit.C)
- Estructura cuaternaria: triple hélice, hacia la derecha
- Porción central fibrilar, extremos más globulares
- Enlaces covalentes que entrecruzan cadenas
- El grado de entrecruzamiento va aumentando con la edad
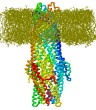
 Estructura del tropocolágeno: Biomodel-1 > Proteínas > Secundaria y Cuaternaria
Estructura del tropocolágeno: Biomodel-1 > Proteínas > Secundaria y Cuaternaria
 Formación de fibrillas y fibras
Formación de fibrillas y fibras
Suplemento opcional ilustrativo: cuadro de "Aplicación clínica 3.4": Síntomas de las enfermedades relacionadas con una síntesis anormal de colágeno
Elastina
Cap. 49: pp. 943-944 .
- Abunda en ligamentos, pulmón, paredes arteriales, piel
- Resistencia mecánica pero con elasticidad
- Sin estructura secundaria regular; estructura 3D aleatoria, variable
- Alto grado de entrecruzamiento entre cadenas aporta la elasticidad
- Enlaces cruzados:
lisina + al-lisina -> lisinonorleucina
lisina + 3 al-lisinas -> desmosina
Proteínas globulares: proteínas plasmáticas, inmunoglobulinas
Proteínas globulares
- Forma elipsoidal, compacta generalmente
- Solubles
- Estructura terciaria, algunas cuaternaria
- Interior predominantemente hidrófobo, apolar; exterior polar
Proteínas plasmáticas
- Cap. 45: pp.859-860
 myEndoConsult.com : Plasma proteins – A comprehensive review ( Overview of plasma proteins | Types of Plasma Proteins | Measurement of Plasma Proteins )
myEndoConsult.com : Plasma proteins – A comprehensive review ( Overview of plasma proteins | Types of Plasma Proteins | Measurement of Plasma Proteins )
 BioNinja.com : Plasma Proteins
BioNinja.com : Plasma Proteins
Conceptos clave:
- Componentes mayoritarios del plasma sanguíneo
- Generalmente aniónicas al pH de la sangre (7,4)
- Muy diversas
- Se agrupan según su comportamiento en electroforesis (su carga, su pI)
- prealbúmina
 albúmina: mayoritaria; función: presión oncótica, tamponamiento, transporte de ácidos grasos
albúmina: mayoritaria; función: presión oncótica, tamponamiento, transporte de ácidos grasos- globulinas alfa1 , alfa2 , beta, gamma1 , gamma2. fig.3.20
- Electroforesis sobre acetato de celulosa o en geles de agarosa, típicamente con un tampón de pH=8,6
- Utilidad diagnóstica a través de los cambios en la abundancia de cada tipo de proteína plasmática: figura 3.21
Suplemento opcional ilustrativo: cuadro de "Aplicación clínica 3.1": Las proteínas plasmáticas en el diagnóstico médico
 Simulador de perfiles electroforéticos normlaes y patológicos
Simulador de perfiles electroforéticos normlaes y patológicos
Gamma-globulinas: anticuerpos
Cap. 7: pp.111-113 y Biomodel-1 > Proteínas > Cuaternaria
- Función de los anticuerpos
- Gran diversidad en su especificidad por un antígeno, pero estructura común en su mayor parte
 Estructura de las IgG
Estructura de las IgG
- 4 cadenas: 2 pesadas (H) y 2 ligeras (L)
- enlaces disulfuro
- región constante y región variable
- oligosacáridos unidos covalentemente: es una glicoproteína
- 3 brazos, cada uno con 4 motivos estructurales similares: "plegamiento de inmunoglobulina" (2 láminas beta apìladas)
- dominios Fab y Fc
- interacción con antígeno: dominios Fab , región variable, ambas cadenas H y L
 Comparación de estructura IgA, IgD, IgE, IgG, IgM Encyclopædia Britannica
Comparación de estructura IgA, IgD, IgE, IgG, IgM Encyclopædia Britannica- Suplemento opcional ilustrativo: cuadro de "Aplicación clínica 9.2": Funciones de las diferentes clase de anticuerpos
Técnicas de estudio de las biomoléculas: técnicas de separación
p. 158-160
Opcional como refuerzo o ampliación:
Roca, Oliver, Rodríguez - Bioquimica: técnicas y métodos (2004) Hélice.  Acceso al texto completo para UAH (eLibro) Cap.9: pp. 118-121, 122-123, 133.
Acceso al texto completo para UAH (eLibro) Cap.9: pp. 118-121, 122-123, 133.
Electroforesis
Basada en la diferente movilidad en un campo eléctrico.
- Variable determinante: carga eléctrica de la molécula. En algunos casos: tamaño de la molécula.
- Electrodos:
- ánodo: hacia donde se mueven los aniones
- cátodo: hacia donde se mueven los cationes
- Soporte de la electroforesis (medio en el que se moverán las moléculas)
- Papel, acetato de celulosa: superficial, baja fricción
- Gel: malla tridimensional, fricción, retarda el avance -- almidón, agarosa, poliacrilamida
 Fundamentos (basta con los apartados "Definición" y "Medios de soporte")
Fundamentos (basta con los apartados "Definición" y "Medios de soporte")
Cromatografía
- Basada en la diferente movilidad entre dos medios:
- Fase estacionaria (frecuentemente sólida)
- Fase móvil (frecuentemente líquida)
- Variable determinante: interacción, afinidad, por cada fase.
- Tipos:
- de reparto
- de adsorción
- de intercambio iónico
- de afinidad
- de exclusión molecular (cap.2)
- Formato:
- plana (en capa fina)
- en columna
 Fundamentos (basta con los apartados 1 a 3.5)
Fundamentos (basta con los apartados 1 a 3.5)
 Separación de moléculas sobre una capa fina (CanalDivulgación, Instituto de Química Orgánica General, CSIC)
Separación de moléculas sobre una capa fina (CanalDivulgación, Instituto de Química Orgánica General, CSIC)
 Separación de moléculas en una columna (Biomodel)
Separación de moléculas en una columna (Biomodel)
 Cromatografía de exclusión molecular, o filtración en gel (Cytiva)
Cromatografía de exclusión molecular, o filtración en gel (Cytiva)
 Cromatografía de exclusión molecular, o filtración en gel (Biomodel)
Cromatografía de exclusión molecular, o filtración en gel (Biomodel)
-fin-
![]() (páginas de la Universidad de La Laguna)
(páginas de la Universidad de La Laguna) 

![]() Estructura del tropocolágeno: Biomodel-1 > Proteínas > Secundaria y Cuaternaria
Estructura del tropocolágeno: Biomodel-1 > Proteínas > Secundaria y Cuaternaria ![]() Formación de fibrillas y fibras
Formación de fibrillas y fibras ![]() Simulador de perfiles electroforéticos normlaes y patológicos
Simulador de perfiles electroforéticos normlaes y patológicos ![]() Acceso al texto completo para UAH (eLibro) Cap.9: pp. 118-121, 122-123, 133.
Acceso al texto completo para UAH (eLibro) Cap.9: pp. 118-121, 122-123, 133.![]() Fundamentos (basta con los apartados "Definición" y "Medios de soporte")
Fundamentos (basta con los apartados "Definición" y "Medios de soporte") ![]() Fundamentos (basta con los apartados 1 a 3.5)
Fundamentos (basta con los apartados 1 a 3.5)![]() Separación de moléculas sobre una capa fina (CanalDivulgación, Instituto de Química Orgánica General, CSIC)
Separación de moléculas sobre una capa fina (CanalDivulgación, Instituto de Química Orgánica General, CSIC)![]() Separación de moléculas en una columna (Biomodel)
Separación de moléculas en una columna (Biomodel)![]() Cromatografía de exclusión molecular, o filtración en gel (Cytiva)
Cromatografía de exclusión molecular, o filtración en gel (Cytiva)![]() Cromatografía de exclusión molecular, o filtración en gel (Biomodel)
Cromatografía de exclusión molecular, o filtración en gel (Biomodel)