Tema 6 - Mioglobina y hemoglobina: proteínas responsables del almacenamiento y la distribución de oxígeno en el organismo
Mioglobina y hemoglobina. Estructura y función. Modulación de la afinidad de la hemoglobina por el oxígeno: cooperatividad y alostería.
+ Variantes de hemoglobina y hemoglobinopatías
Cap.7: pp. 108-111 y Cap.44: 845-846, 850-852 y Biomodel-1 > Proteínas > Hemoglobina
Introducción
La hemoglobina, una proteína paradigmática
- 1ª proteína que se cristalizó (1849)
- Junto a la mioglobina, primeras proteínas cuya estructura se determinó a escala atómica mediante difracción de rayos X.
- 1ª proteína cuya masa molecular se midió con precisión.
- 1ª proteína que se estudió mediante ultracentrifugación.
- 1ª proteína con la que se encontró la base molecular de una enfermedad.
- 1ª proteína en la que se demostró que una mutación puntual en el gen puede alterar la función.
El problema del oxígeno
- Todas las células necesitan suministro constante de O2
- ¿Cómo llega a todo el organismo?
- Difundiendo :-( tráqueas de los insectos
- Disuelto :-(
- Unido a una molécula transportadora :-)
- Proteínas en la hemolinfa de algunos invertebrados hemocianina{Cu}; hemeritrina{Fe}
- Proteínas en la sangre de vertebrados, dentro de células --> hemoglobina en los eritrocitos
- Mantener reservas --> en vertebrados, mioglobina
- Captar aquí, liberar allá
- Cómo fijar O2
- De forma reversible
- Evitando que reaccione
- Imposible con una proteína, posible con un ion metálico
- Fe(II), Cu(I)
- pero no debe oxidarse
- Fe + protoporfirina IX = hemo, en mioglobina y hemoglobina (rojo)
- Fe + una porfirina = otros hemo, en citocromos
- Mg + una porfirina = clorofilas (verde)
- Hemo en el interior de una proteína
- El Fe del hemo une O2
- El hemo en el entorno de la proteína evita la reacción del O2 (la oxidación del Fe)
- El O2 puede liberarse
Estructura de la mioglobina
- Función: almacén de O2 (reversible) en las células del músculo (estriado: esquelético y cardiaco; y liso).
- Primaria, secundaria y terciaria. Molécula de hemo como "grupo prostético". Concepto y definición de grupo prostético (no proteico)
- Concepto de apoproteína y holoproteína.
- Estructura del hemo
- Estructuras secundaria y terciaria de la mioglobina

- Interacción de la globina con el grupo hemo. Coordinación del ion ferroso. Histidinas proximal y distal. (en Biomodel-1)
Grupos no proteicos que forman parte de las proteínas participando en su estructura o en su función:
- Terminología preferida:
- grupo prostético si está unido fuertemente (permanente)
- cofactor si está unido débil y reversiblemente
- Tipos:
- Biomoléculas: lípidos, glúcidos (oligosacáridos)
- Moléculas orgánicas u organometálicas
- Inorgánicos: iones metálicos (Ca, Mg, Zn, Cu), núcleos Fe·S ...
- Apoproteína (sin el grupo no proteico). Holoproteína (completa, con el grupo no proteico)
Estructura de la hemoglobina
- Ejemplo de estructura cuaternaria (en una proteína globular)
- 4 cadenas (subunidades) :: tetramérica, α2β2; globina α, globina β muy parecidas entre sí y a la mioglobina
141 (α) o 146 (β) residuos, ~64 kDa en total
- 4× estructura de mioglobina
- Hay interacción entre subunidades
- Ubicación: eritrocitos, células rojas sanguíneas
- Función:
une O2 reversiblemente: lo transporta --
¿por qué del pulmón a los tejidos?
- Estados:
| |
|
6º ligando |
|
| desoxihemoglobina |
Fe2+ |
(H2O) |
funcional |
| oxihemoglobina |
Fe2+ |
O2 |
funcional |
| metahemoglobina |
Fe3+ |
|
no funcional |
| carboxihemoglobina |
Fe2+ |
CO |
no funcional |
 Diferencias en el espectro de absorción de luz visible entre las formas desoxi-, oxi-, carboxi-, meta- (Postmortem CO-oximetry. C. Higgins, 2014, AcuteCareTesting.Org)
Diferencias en el espectro de absorción de luz visible entre las formas desoxi-, oxi-, carboxi-, meta- (Postmortem CO-oximetry. C. Higgins, 2014, AcuteCareTesting.Org)
(también las puedes explorar en el laboratorio virtual)
Lectura opcional: terapia hiperbárica, en Cap.5, cuadro "Conceptos clínicos" (pon "terapia hiperbárica" en su buscador)
Curvas de saturación con oxígeno
Ensayos en laboratorio, para entender la función.
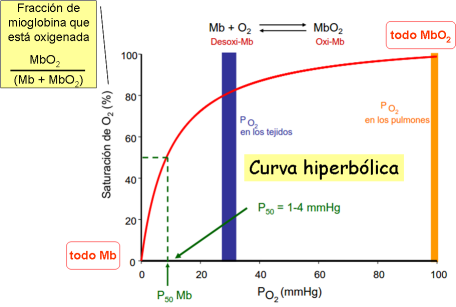 “Curvas de oxigenación”: concentración de O2 disuelto ~ presión parcial de O2 en el entorno (aire, pulmones, celda de ensayo)
“Curvas de oxigenación”: concentración de O2 disuelto ~ presión parcial de O2 en el entorno (aire, pulmones, celda de ensayo)
Vamos variando la PO2 y midiendo cuánta oximioglobina se forma (el espectro de absorción de Mb y MbO2 es diferente;
ejemplo)
Construcción de la curva: significado de las variables: fracción de saturación, presión parcial de oxígeno.
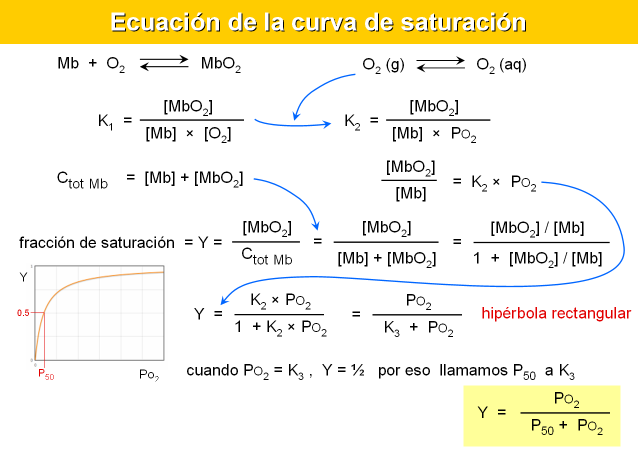
 Simulación de la saturación con oxígeno. (Biomodel)
Simulación de la saturación con oxígeno. (Biomodel)
Interpretación de la forma de la curva (hiperbólica o sigmoide)
- en términos moleculares: cambio conformacional, cooperatividad
- en términos funcionales: facilidad para captar o ceder el oxígeno
- Ejemplos funcionales:
- captación de O2 en los pulmones y entrega en los tejidos
- intercambio entre hemoglobina y mioglobina
- suministro de de O2 desde la madre al feto
 Cambio conformacional de la hemoglobina. Formas T y R. (Biomodel)
Cambio conformacional de la hemoglobina. Formas T y R. (Biomodel)
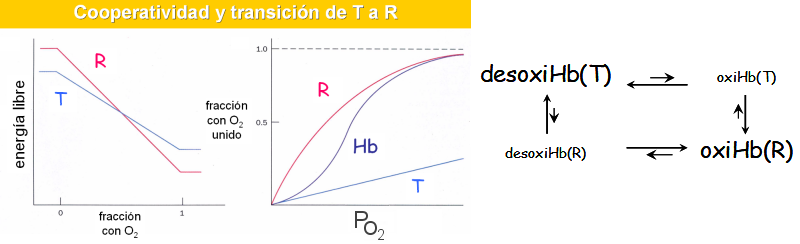
 Animaciones de la transición T/R: oxigenación y cambio conformacional; afinidad y cooperatividad; transporte y cesión del oxígeno; unión del 2,3-BPG
Animaciones de la transición T/R: oxigenación y cambio conformacional; afinidad y cooperatividad; transporte y cesión del oxígeno; unión del 2,3-BPG
Moduladores de la función de la hemoglobina
Cap.44: 845-846,
Primario: concentración de O2. Pero se modula por otras señales:
- CO2 : procedente del metabolismo. Forma carbamatos (-NH-COO−) con grupo amino, estabiliza T
- pH: H+ procedentes del metabolismo y del CO2. His(β) protonada estabiliza T
- 2,3-BPG: regulador; se eleva en altitud, en fumadores, en hipoxia; se une en cavidad central, estabiliza T
- CO: Se une en el sitio del O2 , estabiliza R
Situación en pulmón y en tejidos, interpretación funcional, adecuación fisiológica.
Efecto en la curva de saturación.
Resumen: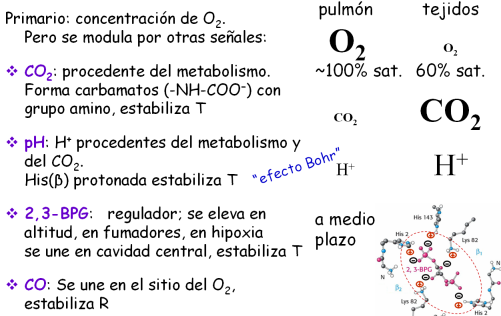

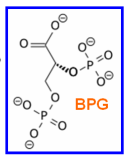
 CC-by-sa Michał Komorniczak
CC-by-sa Michał Komorniczak
Variantes de hemoglobina y hemoglobinopatías
Cap.44: 850-852 .
Variantes en el desarrollo embrionario: hemoglobinas embrionarias, hemoglobina fetal (HbF) y hemoglobinas adultas (HbA, HbA2)
Intercambio de oxígeno entre hemoglobinas materna y fetal 
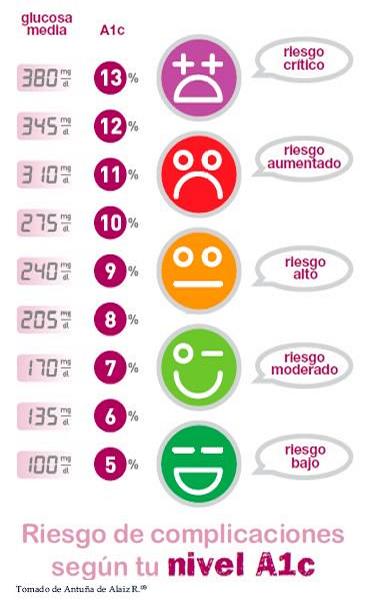 Hemoglobina A glicada (HbA1, HbA1c) (no "glicosilada")
Hemoglobina A glicada (HbA1, HbA1c) (no "glicosilada")
- Glicación: reacción espontánea y no enzimática entre grupo(s) amino de la globina y grupo aldehído de la glucosa
HbA1 = { HbA1a + HbA1b + HbA1c }
Principal: HbA1c
- Utilidad diagnóstica: refleja el promedio de glucemia en un periodo prolongado
- Análisis diagnóstico: �por la diferencia de carga
Hemoglobinopatías:
- HbS, drepanocitosis, anemia de células falciformes (Biomodel-1 > Proteínas > Hemoglobina > Hemoglobina S )
- HbC y otras mutaciones
- Talasemias alfa y beta
-fin-
 “Curvas de oxigenación”: concentración de O2 disuelto ~ presión parcial de O2 en el entorno (aire, pulmones, celda de ensayo)
“Curvas de oxigenación”: concentración de O2 disuelto ~ presión parcial de O2 en el entorno (aire, pulmones, celda de ensayo)
![]() Simulación de la saturación con oxígeno. (Biomodel)
Simulación de la saturación con oxígeno. (Biomodel)![]() Cambio conformacional de la hemoglobina. Formas T y R. (Biomodel)
Cambio conformacional de la hemoglobina. Formas T y R. (Biomodel) 
![]() Animaciones de la transición T/R: oxigenación y cambio conformacional; afinidad y cooperatividad; transporte y cesión del oxígeno; unión del 2,3-BPG
Animaciones de la transición T/R: oxigenación y cambio conformacional; afinidad y cooperatividad; transporte y cesión del oxígeno; unión del 2,3-BPG 


CC-by-sa Michał Komorniczak
![]()
 Hemoglobina A glicada (HbA1, HbA1c) (no "glicosilada")
Hemoglobina A glicada (HbA1, HbA1c) (no "glicosilada")