Tema 11 - Introducción al metabolismo. Bioenergética, oxidorreducción, transporte electrónico y fosforilación.
Introducción al metabolismo
Flujo de materia y energía en la biosfera
- Las células y los organismos vivos son sistemas abiertos que intercambian materia y energía con su entorno.
- Fuente de energía de los organismos vivos:
Fig. 10-3
- Autótrofos: energía solar
- Heterótrofos: compuestos químicos de su entorno (nutrientes)
- Usos de la energía:
- Mantenimiento de la homeostasis celular (reducción de la entropía)
- Biosíntesis
- Trabajo mecánico (desplazamiento, movimiento, contracción muscular)
- con T y P constantes, la única energía que pueden utilizar las células vivas es la energía libre: energía libre de Gibbs (G)
Bioenergética: estudio cuantitativo de la transferencia y utilización de la energía en los sistemas biológicos
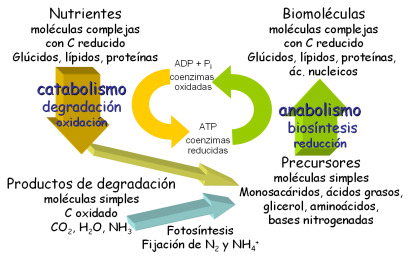 Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11
Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11
- catalizadas enzimáticamente
- transforman la materia, intercambian energía
- Reacciones encadenadas: vías metabólicas
- Interdependientes, conectadas
- Su actividad está coordinada: regulación
Bioenergética
Energía libre
- Energía libre de Gibbs (G): cantidad de energía que se puede convertir en trabajo durante una reacción a temperatura y presión constantes
- Proporciona información sobre:
- La dirección de la reacción química
- Composición en el equilibrio
- La cantidad de energía implicada
- La variación de energía libre (ΔG) de una reacción
- predice si una reacción es factible o no
- ΔG>0 reacción endergónica, consume energía
- ΔG=0 proceso en equilibrio
- ΔG<0 reacción exergónica, libera energía (espontánea)
- ΔG = en las condiciones realmente presentes
- difícil de medir en las condiciones fisiológicas
- ΔG⁰ = variación de energía libre en condiciones estándar
- (25°C, todos 1M, 1 atm)
- no es la real, pero nos sirve como indicador
- ΔG⁰′ para pH=7
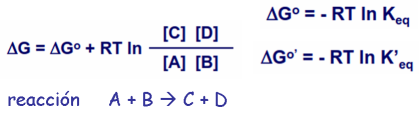
Reacciones acopladas, obtención y uso de energía
En los seres vivos, las reacciones desfavorables, endergónicas, se hacen posibles “acoplándose” con una reacción favorable, exergónica Fig. 10-12
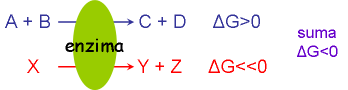 X = compuesto “rico en energía”
X = compuesto “rico en energía”
Los compuestos ricos en energía se obtienen acoplando su formación con reacciones favorables, exergónicas – o bien gracias a la energía de la luz solar
X impulsa reacciones, pero también permite conectar catabolismo con anabolismo
Compuestos “ricos en energía”:
- Son termodinámicamente inestables -- ¿por qué?
- Enlaces que al romperse liberan energía
(al menos 30 kJ/mol)
- Enlace fosfoanhídrido (P—O—P)
- Principales:
ATP  ADP + Pi ; ΔG ≈ −30 kJ/mol
ADP + Pi ; ΔG ≈ −30 kJ/mol
ADP  AMP + Pi
AMP + Pi
- También X + ATP
 ADP + X-P (esto puede considerarse acoplamiento de reacciones) = transferencia de fosfato, fosforilación
ADP + X-P (esto puede considerarse acoplamiento de reacciones) = transferencia de fosfato, fosforilación
- Fig. 10-10
- Otros anhídridos por ej. fosfórico-carboxílico (anhídridos mixtos)
- Ej.: 1,3-bisfosfoglicerato
- fosfoenoles. Ej.: fosfoenolpiruvato
- tioésteres. Ej: acetil-coenzima A
- fosfoguanidinas. Ej: fosfocreatina
- ¿Qué hace al ATP inestable?
Los productos tienen:
- mayor solvatación, más espacio para interacción con el disolvente (enlaces de H)
- separación de cargas que se repelen
- imagen
 Compuestos ricos en energía (incluye autoevaluación)
Compuestos ricos en energía (incluye autoevaluación)
Ejemplo de acoplamiento energético: fosforilación de la glucosa a glucosa-6-fosfato
ATP y metabolismo: El ATP es un índice de la carga energética de la célula (cociente ATP/ADP)
El ATP es un índice de la carga energética de la célula (cociente ATP/ADP)
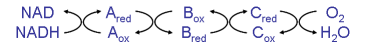
Oxidorreducción biológica
- Los procesos metabólicos son redox en buena parte
Fig. 10-13
- Además de intercambio energético hay producción o gasto de “equivalentes de reducción”
- Las coenzimas redox sirven para ello y permiten conectar las reacciones de oxidación (catabolismo) con las reductoras (anabolismo)
- equivalentes redox
 energía química
energía química
- Estructura* y reacción redox de las principales coenzimas:
- NAD, dinucleótido de nicotinamida y adenina
- NAD+ + H+ + 2 e−
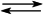 NADH
NADH
NAD+ + 2 H+ + 2 e− 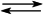 NADH + H+
NADH + H+
- NADP, fosfato del dinucleótido de nicotinamida y adenina
- FAD, dinucleótido de flavina y adenina
FAD + 2 H+ + 2 e− 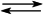 FADH2
FADH2
FMN + 2 H+ + 2 e− 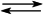 FMN2
FMN2
- FMN, mononucleótido de flavina
- *) estructuras en Biomodel

- Ejemplo de oxidorreducción biológica: Reacción catalizada por lactato deshidrogenasa
Potencial de reducción
- Reducción = ganancia de electrones, A + e−
 A−
A−
- Reductor: tiene capacidad para ceder sus electrones a otra molécula, para ello se oxida (cede electrones)
- Puesto que la semirreacción de reducción es captación A + e−
 A− ; E⁰ < 0
A− ; E⁰ < 0
el potencial “de reducción” de “A”, para captar electrones, es bajo; valor E⁰ bajo (muy negativo) corresponde a reductores potentes.
- Potencial normal o estándar, E⁰: a 25°C, 1 atm, 1M
E⁰′ es a pH=7 (mejor referencia)
- Para una especie, pareja forma oxidada / forma reducida:
- referencia hidrógeno: E⁰ = 0
H++ e−  ½ H2
½ H2
- reductores: E⁰ < 0; más reductor: potencial más negativo
- oxidantes: E⁰ > 0 (pero siempre es relativo)
- Ejemplo en una reacción redox:
| |
piruvato + 2H+ + 2e− |
 |
lactato |
; E⁰′ = −0.1 V |
| |
NADH |
 |
NAD + H+ + 2e− |
; E⁰′ = −(−0.32 V) |
| suma: |
piruvato + NADH + H+ |
 |
lactato + NAD |
; ΔE⁰′ = +0.13 V |
- ΔG⁰ = −n · F · ΔE⁰ (cte. de Faraday F=96.48 kJ·mol−1·V−1) ; ΔE⁰′>0 ; ΔG⁰′<0, reacción espontánea
Flujo o transporte de electrones
Potenciales normales de reducción

- los electrones fluyen, se transfieren...
- desde las especies más reductoras
- hacia las menos reductoras / más oxidantes
- ej.: del NADH al piruvato
- E⁰1 < E⁰2 ; −E1 + E2 = ΔE⁰ >0 ; ΔG⁰ <0, espontánea
La mitocondria
- Membrana mitocondrial externa
- Membrana mitocondrial interna
- Matriz
Obtención de energía a partir de los equivalentes de reducción
Resumen:
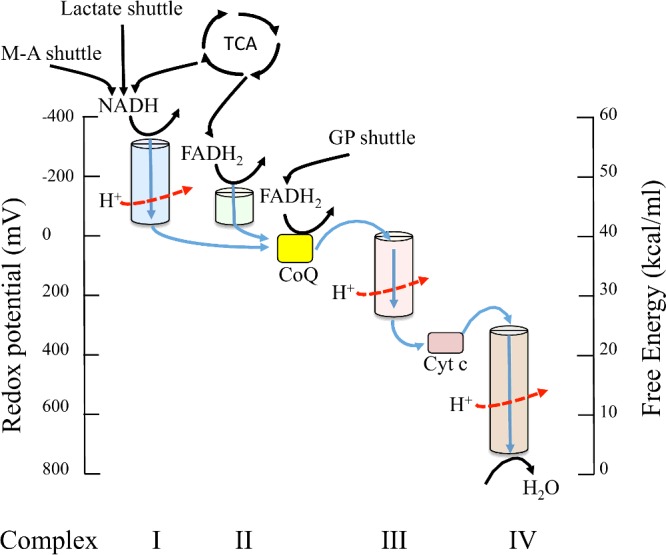
- En el interior de la mitocondria, el NADH y el FADH2 producidos en el catabolismo (oxidación de los nutrientes) van a conducir a la obtención de energía.
- Se da un proceso de “transporte electrónico” mediante una cadena de reacciones de reducción que tienen lugar en complejos proteicos insertados en la membrana mitocondrial interna
- a la vez se produce un transporte de protones, generando un gradiente entre el interior de la mitocondria y el espacio intermembranario.
- Dicho
gradiente de protones impulsa ("fuerza protón-motriz") la fosforilación del ADP (fosforilación oxidativa)
Cadena de transporte electrónico mitocondrial
Fig. 12-10
Conceptos más importantes del transporte electrónico mitocondrial:
- Los transportadores son
- complejos proteicos integrales en la membrana (I, II, III, IV), cada uno formado por varias subunidades
- contienen varios grupos prostéticos redox
- un transportador soluble en la bicapa: un lípido, la ubiquinona o coenzima Q
- un transportador soluble en agua: el citocromo c
- Transporte de electrones: 2 rutas:
- (metabolitos
 ) NADH
) NADH  cI
cI  Q
Q
- metabolitos
 {FADH2 · cII}
{FADH2 · cII}  Q
Q
- final común: Q
 cIII
cIII  cit.c
cit.c  cIV
cIV  O2
O2
- dentro de cada complejo hay un transporte de electrones entre sus cofactores redox
- El transporte de electrones (a lo largo de la membrana) va acompañado de una translocación de protones, o transporte a través de la membrana; salen protones de la matriz mitocondrial al espacio intermembranario.
- El transporte tiene lugar en orden creciente de potencial de reducción (de más reductor ΔE⁰<<0, a más oxidante, ΔE⁰>>0)
Información del conjunto y de cada complejo: en  Biomodel > Metabolismo
Biomodel > Metabolismo
|
licencia CC-by; Ballard & Youngson, doi:10.1042/BSR20150232
Leyenda:
- Lactate shuttle = lanzadera de lactato
- M-A shuttle = lanzadera de malato y aspartato
- TCA = ciclo de ácidos tricarboxílicos (ciclo de Krebs)
- GP shuttle = lanzadera de glicerol-fosfato
|
Fosforilación oxidativa
Fig. 12-10, 12-11
Balance del gradiente de protones generado: consulta diagrama en Biomodel
- a partir de 1 NADH: 2 e−, 10 H+, ½ molécula oxígeno
- a partir de 1 FADH2: 2 e−, 6 H+, ½ molécula oxígeno
"fuerza protón-motriz", gradiente electroquímico
ATP sintasa
Modelo quimiosmótico: el gradiente de protones impulsa la acción de la ATP sintasa, que sintetiza ATP fosforilando el ADP con Pi.
Conceptos más importantes de la fosforilación oxidativa:
- Estructura de la ATP sintasa (2 dominios):
- complejo Fo, insertado en la membrana, giratorio (aprox.)
- complejo F1, expuesto en la matriz, estático (aprox.)
- Descripción de las subunidades:
Hace falta aprender estos detalles
-
| subunidades |
forma parte de |
carácter |
ubicación |
movimiento |
| c12 "carrusel" |
Fo |
hidrófobo |
membrana |
giratorio |
| (α β)3 |
F1 |
hidrófilo |
matriz |
estático |
| γ δ ε "eje" |
¿ Fo / F1 ? |
|
|
giratorio |
| a |
( Fo ) |
hidrófobo |
membrana |
estático |
| b2 |
¿? |
|
ambas |
estático |
- El paso de protones a través de a y c hace girar
el "carrusel" c12
- Esto hace girar también el "eje" γ ε ¿δ?
- El giro de γ provoca cambios conformacionales en las subunidades α y β
- Los cambios conformacionales en α y β activan la catálisis = síntesis del ATP = fosforilación
- Un giro completo del "carrusel" c12 (n= 10 / 12 / 14)
- corresponde al paso de 12 protones (aprox.)
- induce 1 ciclo completo en los 3 dímeros αβ: síntesis de 3 moléculas de ATP
- El rendimiento (aprox.) es de 1 ATP por cada 4 protones que pasan.
Más información (subunidades componentes, papel de cada una, mecanismo) en  Biomodel > Metabolismo
Biomodel > Metabolismo
Balance:
- a partir de 1 NADH: 10 H+, 2'5 ATP
- a partir de 1 FADH2: 6 H+, 1'5 ATP
(En libros antiguos podéis encontrar las cifras 3 y 2 ATP; ya son obsoletas)
Interferencia en el proceso:
(Basta con una idea general)
- Inhibidores
- bloquean el equilibrio redox de alguno de los transportadores electrónicos
- cianuro ; CO ; azida (envenenamiento)
- antimicina A1 (antibiótico)
- rotenona (insecticida, plaguicida)
- amital (barbiturato) ; demerol (contra el dolor)
- 2-tenoiltrifluoroacetona ; carboxina
- o bloquean la ATP sintasa
- oligomicina ; diciclohexilcarbodiimida
- Desacoplantes
- alteran (suprimen) el gradiente de protones
- ej.: gramicidina A, forma un canal a través de la membrana (es antibiótico)
- 2,4-dinitrofenol ; dicumarol ; hidrófobos pero también ácidos; si se desprotonan tienen carga
Transporte electrónico fotosintético
Resumen de fotosíntesis
- reacciones dependientes de la luz
- Captación de energía luminosa
- Transporte electrónico en la membrana del cloroplasto.
- Traslocación de protones asociada.
- Síntesis de ATP
- reacciones independientes de la luz
- Fijación fotosintética del CO2, síntesis de carbohidratos (ciclo de Calvin) (en el Tema 16)
Resumen de la fase dependiente de la luz:
- Fijación de la energía de la luz solar en energía química: NADPH y ATP
- Radiación luminosa
-
 moléculas energéticamente excitadas
moléculas energéticamente excitadas  liberación de electrones
liberación de electrones
-
 transporte electrónico
transporte electrónico  NADPH
NADPH
-
 bombeo de protones asociado
bombeo de protones asociado  producción de ATP
producción de ATP
Estructura del cloroplasto
-es.svg/500px-Chloroplast_(borderless_version)-es.svg.png) Commons
Commons
3 membranas: externa, interna, tilacoidal Fig.13-3, 13-4
3 espacios: intermembranario, estroma, luz (lumen)
Notas:
- estroma: fluido acuoso = interior del cloroplasto
- luz o lumen = interior del tilacoide
- granum (plural: grana) = apilamiento de tilacoides - micrografía electrónica (por ej. Stryer 2014 fig.22.2.B)
- laminilla o lamela = conexión entre grana
Transporte fotosintético de electrones
 Esquemas y contenido en Biomodel > Metabolismo
Esquemas y contenido en Biomodel > Metabolismo
Participan (aprended los nombres):
- centro de formación de oxígeno (OEC)
- fotosistema II (PSII)
- plastoquinona
- citocromos
- plastocianina
- fotosistema I (PSI)
- ferredoxina
- NADP reductasa
LHC: complejo captador de luz
- proteínas
- pigmentos “antena”
|
PSII: fotosistema II
- complejo de proteínas transmembranarias
- pigmentos y grupos prostéticos
- clorofilas, P680
- caroteno β
- plastoquinona
- hemo
- feofitina
|
PSI: fotosistema I
- complejo de proteínas transmembranarias
- pigmentos y grupos prostéticos
- clorofilas, P700
- caroteno β
- filoquinona
- núcleos Fe4S4
|
Energía: el “esquema Z” .svg/500px-Z-scheme_(cs).svg.png) Commons
o bien Fig.13-13
Commons
o bien Fig.13-13
Conceptos más importantes del transporte electrónico fotosintético:
- Los transportadores son
- complejos proteicos integrales en la membrana (PSII, cit.bf, PSI)
- cada uno formado por varias subunidades
- contienen varios grupos prostéticos redox
- un transportador soluble en la bicapa: un lípido, la plastoquinona
- dos transportadores solubles en agua: plastocianina y ferredoxina
- una enzima soluble en agua: NADP reductasa
- Transporte de electrones: una sola ruta
- H2O
 PSII
PSII  PQ
PQ  cit.bf
cit.bf  PC
PC  PSI
PSI  Fd
Fd  NADP
NADP
- dentro de cada complejo hay un transporte de electrones entre sus cofactores redox
- en los complejos PS hay aportación de energía a los electrones a través de los pigmentos
- El transporte de electrones (a lo largo de la membrana) va acompañado de una translocación de protones, o transporte a través de la membrana;
- salen (¿?) protones del estroma cloroplástico al espacio intratilacoidal.
- El transporte tiene lugar en orden creciente de potencial de reducción (de más reductor ΔE⁰<<0, a más oxidante, ΔE⁰>>0)
pero hay dos pasos de excitación para conseguirlo
Fotofosforilación
Balance del gradiente de protones generado: consulta diagrama en Biomodel
- a partir de 1 H2O: 2 e−, 6 H+, 1 NADPH
De nuevo: "fuerza protón-motriz", gradiente electroquímico, modelo quimiosmótico, ATP sintasa
Balance: Para producir una molécula de O2:
Comparación mitocondria - cloroplasto
-(fin)-
 Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11
Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11 Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11
Metabolismo: Conjunto ordenado de reacciones que se producen en las células Fig. 10-2, 10-11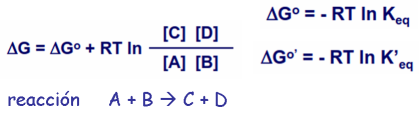
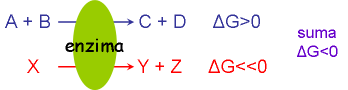 X = compuesto “rico en energía”
X = compuesto “rico en energía”![]() Compuestos ricos en energía (incluye autoevaluación)
Compuestos ricos en energía (incluye autoevaluación)  El ATP es un índice de la carga energética de la célula (cociente ATP/ADP)
El ATP es un índice de la carga energética de la célula (cociente ATP/ADP)
![]() Biomodel > Metabolismo
Biomodel > Metabolismo
![]() Biomodel > Metabolismo
Biomodel > Metabolismo -es.svg/500px-Chloroplast_(borderless_version)-es.svg.png) Commons
Commons ![]() Esquemas y contenido en Biomodel > Metabolismo
Esquemas y contenido en Biomodel > Metabolismo .svg/500px-Z-scheme_(cs).svg.png) Commons
o bien Fig.13-13
Commons
o bien Fig.13-13