Tema 12B - Destinos del piruvato
Contexto: Procedencia del piruvato.
- ¿De qué ruta metabólica? …………..
- ¿En qué compartimento subcelular? ……………..
- A partir de un mol de glucosa se producen …….. moles de piruvato
Resumen de estas vías:
- Pyr
 etanol + CO2 .
etanol + CO2 .
- Pyr
 lactato .
lactato .
- Pyr
 acetil-CoA + CO2 .
acetil-CoA + CO2 .
¿Qué se obtiene?
- Regeneración del NAD utilizado en la glucólisis.
- Continuar la oxidación para la obtención de energía: ATP + CO2 + H2O .
Destinos en condiciones anaeróbicas (fermentaciones)
¿Qué es una fermentación?
Sustratos y productos de algunas fermentaciones.
Aplicaciones prácticas de la fermentación: biotecnología tradicional.
Recordatorio: gasto de NAD en la glucólisis -- Reacción nº6, de GA3P a 1,3BPG
Si no se puede hacer fosforilación oxidativa, es necesario regenerar el NAD para que pueda mantenerse la glucólisis.
- F. láctica
- Reducción del piruvato a lactato.
- En microorganismos y en el músculo en ejercicio.
- Alcohólica
- Reducción del piruvato a etanol.
- En microorganismos.
Acoplan la reducción del piruvato con la oxidación del NADH.
Rendimiento energético
- Es inferior a la oxidación completa
- Entonces, ¿por qué se usa?
Fermentación láctica
Reacción y enzima: LDH.
Isoenzimas de LDH. Propiedades diferenciales.
- LDH: tetrámero, 4 subunidades de 2 tipos posibles (H y M)
- 5 isoenzimas de LDH: algunas diferencias, pero catalizan la misma reacción.
- M y H codificadas en diferentes loci (gen M, gen H)
- Aunque catalizan la misma reacción difieren en sus valores de Km para el piruvato.
- Además, el piruvato inhibe alostéricamente H4 pero no M4.
- Análisis de isoenzimas en Biomodel > Laboratorios virtuales
Balance, sumando la glucólisis: Glucosa + 2 ADP + 2 Pi 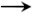 2 lactato + 2 ATP + 2 H2O
2 lactato + 2 ATP + 2 H2O
Ejemplos de glucólisis anaeróbica:
Ejercicio puntual intenso.
Parto: neonato (glucólisis anaerobia, con peligro de acidosis láctica).
Crecimiento tumoral.
Fermentación alcohólica
Reacciones y enzimas: piruvato descarboxilasa, alcohol deshidrogenasa.
Balance, sumando la glucólisis: Glucosa + 2 ADP + 2 Pi 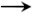 2 etanol + 2 HCO3− + 2 ATP
2 etanol + 2 HCO3− + 2 ATP
Enzimas
- Piruvato descarboxilasa
- En levaduras y en bacterias
- Descarboxilación no oxidativa
- coenzima: pirofosfato de tiamina (TPP); proviene de la vitamina B1; portador de “grupos aldehídos activos”
- coenzima TPP en Biomodel
- Alcohol deshidrogenasa
- No sólo en levaduras, también en hígado
- Necesaria para el metabolismo del etanol en la dieta
- coenzima: Zn2+ .
Destino en condiciones aeróbicas (oxidación)
Ubicación subcelular: matriz mitocondrial
Reacción y enzima: piruvato deshidrogenasa (complejo enzimático)
Balance, sumando la glucólisis: Glucosa + 2 ADP + 2 Pi + 4 NAD + 2 CoA 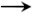 2 AcCoA + 2 HCO3− + 2 ATP + 4 NADH
2 AcCoA + 2 HCO3− + 2 ATP + 4 NADH
Estructura del acetil-CoA
- tioéster
- compuesto “de alta energía” (su hidrólisis tiene ΔG muy negativa, −31.5 kJ/mol, frente a −30.5 kJ/mol del ATP)
- portador de grupo acetilo “activado”
- coenzima A en Biomodel
Fuentes y destinos del acetil-CoA (resumen); el AcCoA es un punto central de distribución en las rutas metabólicas.
El complejo de la piruvato deshidrogenasa
- Oxidación aeróbica a acetil-CoA
- Es un complejo multienzimático
- Gran tamaño: 4,5 MDa en E. coli; 9-10 MDa en mamíferos
¡Mayor que un ribosoma! (2,5 MDa y 4,2 MDa respectivamente)
- Relacionado con otros complejos homólogos, entre ellos la α-cetoglutarato deshidrogenasa (en ciclo de Krebs)
- Se pasan grupos de unos centros activos a otros, gracias a un conector largo y flexible
Animaciones de las reacciones del complejo de la piruvato deshidrogenasa:
Complejo de la piruvato deshidrogenasa
(nc)
unido a la enzima de forma no covalente
(c)
unido a la enzima de forma covalente (amida con el grupo amino e de la cadena lateral de Lys)
(s)
soluble
TPP = pirofosfato de tiamina = tiamina-pirofosfato = tiamina-difosfato
|
| enzimas
|
coenzimas
|
catalíticas,
no se consumen,
grupos prostéticos
|
estequiométricas,
cosustratos,
se transforman
|
E1
EC 1.2.4.1
piruvato deshidrogenasa
|
TPP
nc
Mg2+
|
|
E2
EC 2.3.1.12
dihidrolipoamida transacetilasa
|
lipoamida
c
|
coenzima A
s
= CoA-SH |
E3
EC 1.8.1.4
dihidrolipoamida deshidrogenasa
|
FAD nc
|
NAD+ s
|
Estudio de las coenzimas del complejo... [Coenzimas en Biomodel]
Reacciones catalizadas por el complejo enzimático PDH (esquema en Biomodel)
Utilidad de un complejo multienzimático:
- menor difusión de productos intermedios: mayor velocidad de la reacción
- menos reacciones colaterales (canalización)
- control integrado de todas las etapas
Regulación del complejo enzimático PDH
- Reacción irreversible en los animales
- Destino inevitable de la glucosa: CO2 o bien lípidos
- 2 mecanismos de regulación:
-
alostérica inhibición competitiva por producto
- covalente
- Inhibición por productos
- NADH inhibe* E3
- acetil-CoA inhibe* E2
- El producto compite con el sustrato (reacciones reversibles)
- Regulación covalente: Fosforilación y desfosforilación (eucariotas)
- La fosforilación inactiva la PDH
- (adiposo e hígado) La insulina estimula la fosfatasa :: activa la PDH :: gasto de glucosa
- Señal de contracción muscular: aumenta [Ca2+]: activa la fosfatasa :: estímulo metabólico en ejercicio
- Regulación directa de las enzimas del complejo + regulación a través de la quinasa y la fosfatasa
Cocientes elevados:
- ATP / ADP :: PDH poco activa
- NADH / NAD+ :: PDH poco activa
- AcCoA / CoA :: PDH poco activa
- Piruvato :: PDH activa
- Ca2+ :: PDH activa (al menos en músculo)
-(fin)-
![]() 2 lactato + 2 ATP + 2 H2O
2 lactato + 2 ATP + 2 H2O ![]() 2 etanol + 2 HCO3− + 2 ATP
2 etanol + 2 HCO3− + 2 ATP ![]() 2 AcCoA + 2 HCO3− + 2 ATP + 4 NADH
2 AcCoA + 2 HCO3− + 2 ATP + 4 NADH