Se realiza un ensayo de lactato deshidrogenasa en una muestra de suero, mezclando los componentes indicados en la tabla.
lactato + NAD ![]() piruvato + NADH
piruvato + NADH
| lactato 200 mM | NAD 200 mM | tampón Tris 200 mM, pH=6.8 | suero |
| 150 µL | 150 µL | 600 µL | 100 µL |
Al cabo de 2 minutos de iniciar la reacción se detecta espectrofotométricamente la formación de 7 µmol de NADH.
Calcula:
a) En la mezcla de reacción AEr = 7 µmol / 2 min = 3.5 µmol/min = 3.5 U = 59 nkat
b) En la alícuota de suero empleada AEs = 3.5 µmol/min (la cantidad de enzima en los 100 µL de suero es la misma que hay en la mezcla completa)
c) En el suero [AE]s = 3.5 µmol/min / 100 µL = 35 mM/min = 35000 U/L = 0.583 mkat/L
d) En el suero AEEs = 35 mM/min / 30 g/L = 1.17 (mmol/min)/(g proteínas) = 1.17 mmol min−1 g−1 = 1170 U/g = 19.5 µkat/g
Se realiza un ensayo de lactato deshidrogenasa en una muestra de suero, mezclando los componentes indicados en la tabla.
lactato + NAD ![]() piruvato + NADH
piruvato + NADH
| lactato 200 mM | NAD 200 mM | tampón Tris 200 mM, pH=6.8 | suero |
| 150 µL | 150 µL | 600 µL | 100 µL |
Al cabo de 3 minutos de iniciar la reacción se detecta espectrofotométricamente una concentración 6 mM de NADH.
Calcula:
a) En la mezcla de reacción AEr = 6 mM × 1 mL / 3 min = 2 µmol/min = 2 U = 33 nkat
b) En la alícuota de suero empleada AEs = 2 µmol/min = 2 U = 33 nkat
c) En el suero [AE]s = 2 µmol/min / 100 µl = 20 mM/min = 20000 U/L = 0.33 mkat
d) En el suero AEEs = 20 mM/min / 30 g/l = 0.67 (mmol/min)/(g proteínas) = 0.67 mmol min−1 g−1
o bien
AEEs = 2 µmol/min / (30 g/l × 100 µl) = 0.67 mmol min−1 g−1 = 670 U/g = 11.2 µkat/g
Se ha purificado fosfatasa alcalina a partir de una muestra de hueso, consiguiendo que muestre una sola banda cuando se analiza por electroforesis. El volumen de la disolución de enzima purificada es de 2.5 ml. Cuando se mide su concentración de proteína, se obtiene un valor de 5.5 mg/ml.
Se prepara un ensayo para determinar su actividad según la reacción indicada debajo, mezclando los componentes indicados en la tabla.
p-nitrofenil-fosfato ![]() p-nitrofenol + Pi
p-nitrofenol + Pi
| pNFP 50 mM | tampón bicarbonato 100 mM, pH=10.5 | agua | enzima purificada |
| 100 µl | 500 µl | 1200 µl | 200 µl |
5 minutos tras añadir la enzima se añaden 0.5 ml de NaOH para detener la reacción y cuantificar el color amarillo del pNF, lo que proporciona un resultado de 0.4 mM de pNF.
Calcula la actividad enzimática específica de la fosfatasa alcalina purificada.
Se ha formado pNF: 0.4 mM × 2.5 ml = 1 µmol de pNF
En la mezcla de reacción AEr = 1 µmol / 5 min = 0.2 µmol/min = 0.2 U = 3.33 nkat
La cantidad de proteína en los 200 µl ensayados es 5.5 mg/ml × 0.2 ml = 1.1 mg
así que AEE = 0.2 µmol/min / 1.1 mg = 0.18 mmol min−1 g−1 = 180 U/g = 3.0 µkat/g
Una muestra contiene la enzima X, cuya actividad se puede medir siguiendo la reacción que cataliza,
A ![]() B + C
B + C
La aparición de B se detecta gracias a su absorbancia a 480 nm, longitud de onda a la que posee un coeficiente de extinción de 8800 M−1 cm−1
La medida de la concentración total de proteínas en la muestra rindió un valor de 20 mg/mL.
Se tomaron 100 µL de la muestra, combinándolos con 25 µL de disolución 200 mM del sustrato y 1875 µL de un tampón adecuado para la enzima. Al registrar la absorbancia de esta mezcla, se midió un aumento de absorbancia de 0.01 cada minuto.
Calcula:
a) Puesto que A = ε × c × l , dA/dt = ε × dc/dt × l
Como [AE] es lo mismo que
dc/dt, en la mezcla de reacción [AE]r = 0.01 min−1 × (1/8800) M cm × 1/(1 cm) = 1.14·10−6 M/min = 1.14 µM/min = 1.14 U/L
o bien 38 nkat/L
b) [AE]m × 100 µL = [AE]r × 2000 µL ; [AE]m = 22.8 U/L o bien 760 nkat/L o 0.76 Ķkat/L
c) AEEm = (22.8 U/L) / (20 g prot./L) = 1.14 U/g o bien 38 nkat/g
La β-galactosidasa puede hidrolizar el compuesto o-nitrofenil-β-D-galactopiranósido (ONPG) para producir galatosa y o-nitrofenol (ONP), que en medio alcalino tiene color amarillo
con un máximo de absorbancia a 615 nm y un coeficiente de extinción 4500 M−1cm−1.
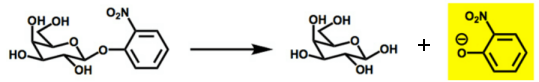
Se mezclan en una cubeta de espectrofotómetro 900 µL de tampón de pH=7.3, 80 µL de disolución 100 mM de ONPG y 20 µL de una muestra que contiene β-galactosidasa.
Transcurridos 5 min, se añade 1 mL de NaOH 1M para detener la reacción (por inactivación de la enzima).
En esos 5 min la absorbancia a 615 nm aumentó en 0.35
Calcula:
a) Puesto que A = ε × c × ℓ , dA/dt = ε × dc/dt × ℓ
Como [AE] es lo mismo que
dc/dt, AE = V × [AE] = V × dA/dt / ( ε × ℓ )
Teniendo en cuenta que la absorbancia se ha medido en el volumen final, V = 2 mL:
AEf = 2 mL × [AE]f = 2·10−3 L × (0.35 / 5 min) × (1/4500) M cm × 1/(1 cm) = 3.11·10−8 mol/min = 0.0311 µmol/min = 0.0311 U<
y la cantidad de enzima es la misma tanto en el volumen final como en el previo durante la reacción, es decir, su AE se mantiene:
En la mezcla de reacción AEr = 0.0311 U o bien 0.519 nkat
b) De nuevo, la cantidad de enzima es la misma en los 20 µL de muestra iniciales que en la mezcla de reacción:
AEm = AEr = 0.0311 U o bien 0.519 nkat