El agua como medio biológico. pH y tampones fisiológicos. + Polaridad e hidrofobia. + Interacciones no covalentes.
Cap.4: pp. 53-60 (paginación del visor de eLibro)
El agua en el organismo: disolvente y termoregulador.
Estructura molecular
![]() Polaridad del agua y de otras moléculas.
Polaridad del agua y de otras moléculas.
![]() Enlaces de hidrógeno en el agua. El agua como disolvente.
Enlaces de hidrógeno en el agua. El agua como disolvente.
![]() Enlaces de hidrógeno entre agua y otras moléculas
Enlaces de hidrógeno entre agua y otras moléculas
![]() Modos de vibración de la molécula de agua (Muestra cómo las moléculas son dinámicas, sufren cambios conformacionales)
Modos de vibración de la molécula de agua (Muestra cómo las moléculas son dinámicas, sufren cambios conformacionales)
Constante de equilibrio en una reacción química. Definición de pKa.
Ley de acción de masas: desplazamiento del equilibrio.
Disociación del agua en iones hidrógeno (o hidronio) e hidróxido.
Definición de pH
| Fluido | pH |
|---|---|
| plasma sanguíneo | 7.4 |
| fluido intersticial | 7.4 |
| fluido intracelular | |
| citosol (hepatocitos) | 6.9 |
| luz de los lisosomas | <5 |
| jugo gástrico | 1.5 a 3.0 |
| jugo pancreático | 7.8 a 8.0 |
| leche humana | 7.4 |
| saliva | 6.4 a 7.0 |
| orina | 5.0 a 8.0 |
pH del plasma sanguíneo: acidosis y alcalosis. 
Modelo y ecuación de Henderson y Hasselbalch.
![]() Ejercicios de cálculo de pH y tampones (con autoevaluación)
Ejercicios de cálculo de pH y tampones (con autoevaluación)
A1 a A4 fundamentales; A5 un poco más difícil.
B1 a B3 fundamentales.
C1 y C2 más avanzados
Disoluciones reguladoras del pH (tampones)
Equilibrios ácido-base del bicarbonato (carbonato, bicarbonato, ácido carbónico y dióxido de carbono). Presión parcial de CO2.
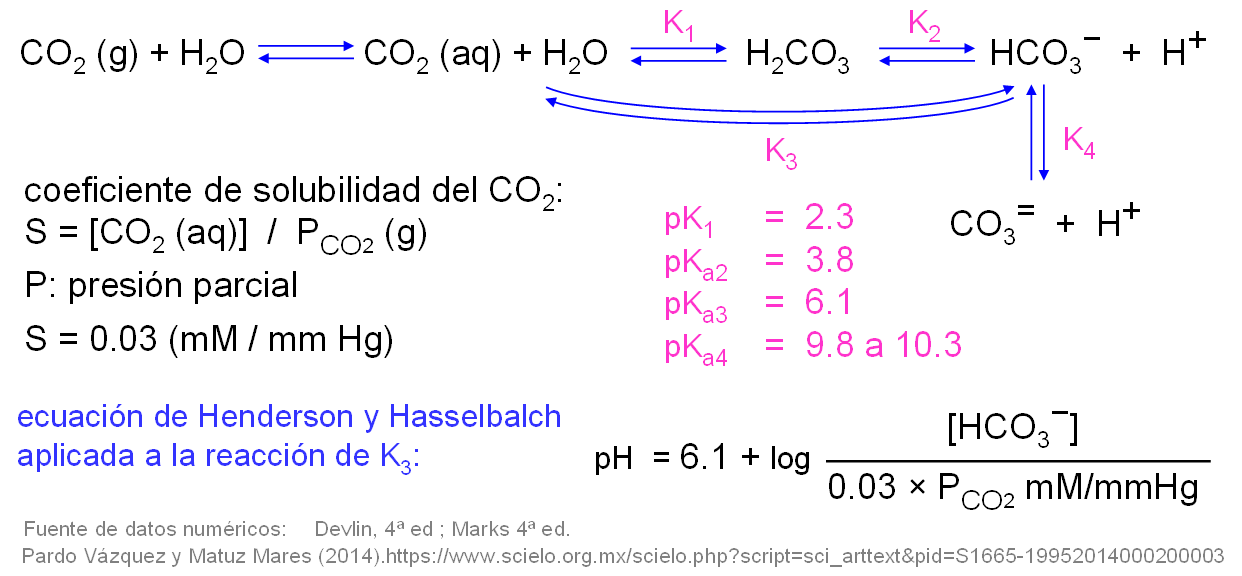 pulsa en la imagen para ampliarla
pulsa en la imagen para ampliarla


Otros sistemas tampón fisiológicos:
cap. 3.2 y 3.5
Cap. 5: p.68
![]() Agua
Agua ![]() Polaridad
Polaridad

-fin-