Temas 7 y 8 - Enzimas
7) Concepto, clasificación y nomenclatura de las enzimas. Conceptos de coenzima, centro activo y especificidad. Mecanismo de la catálisis enzimática. Cinética enzimática. Reacciones enzimáticas con un solo sustrato: modelo de Michaelis y Menten. Linealización de la ecuación. Inhibición de las enzimas.
8) Regulación de la actividad enzimática: su necesidad. Reacción limitante. Regulación por modificación de la cantidad de enzima. Regulación por modificación de la eficiencia catalítica: zimógenos, modificación covalente, enzimas alostéricas. Isoenzimas.
Marks, cap. 8 y 9
8.I (p.124) Introducción a las enzimas. Clasificación (pp. 141-4)
8.I.A,B (pp.125-7) Sitio activo y sitio de unión de los sustratos; modelos de unión
8.I.C (pp.127-8) Estado de transición
8.II.A,B (pp.128-31) Ejemplo de mecanismo catalítico: quimotripsina
8.II.C (pp.131-2) Energía en presencia de la enzima
8.III (pp.132-7) Grupos funcionales que intervienen en la catálisis. Coenzimas y cofactores
8.IV (pp.137-8) Influencia del pH y la temperatura
8.V (pp.138-41) Inhibidores: covalentes, análogos, iones metálicos. Sólo la idea general, no los detalles.
9.I (pp.147-8) Introducción a la regulación. Refuerzo fuera del libro: definiciones de AE, [AE] y AEE. Definición de velocidad de reacción. Reversibilidad.
9.II.A (pp.148-50) Velocidad e influencia de la concentración de sustrato. Modelo de Michaelis y Menten, Isoenzimas. Influencia de la concentración de enzima.
9.II.B (p.150) Inhibidores reversibles: tipos
9.III Regulación por cambios conformacionales
9.III.A (pp.151-3) Alostería. Cooperatividad. Efectores
9.III.B (pp.153-4) Regulación por modificaciones covalentes
9.III.C (pp.154-5) Regulación por interacción entre proteínas
9.III.D (p.156) Regulación por escisión proteolítica
9.V (p.157) Regulación de las vías metabólicas
+ Isoenzimas (pp.91-92, 149, 158)
I. Introducción, conceptos, terminología
- Concepto y definición de catalizador en química
- Concepto y definición de enzima
- ¡atención! No todas las enzimas son proteínas, algunas son RNA (ribozimas)
- Necesidad de las enzimas en los seres vivos
- Velocidad de las reacciones
- Control de las reacciones dependiendo de necesidades de la célula o del organismo
- Características clave de las enzimas
- Especificidad por los sustratos
- Muy elevada eficiencia catalítica
- Actúan en condiciones fisiológicas (pH, T)
- Regulables
- Relevancia de las enzimas ¿Por qué las estudiamos?
- Biológica ...
- Aplicada
- Industrial
- Alimentaria – ablandar carne, fabricación de queso, comida de bebé, clarificación de zumos; usos de las levaduras
- Transformación de productos – producción de glucosa, jarabe de fructosa, comida de animales
- Industrias textil y del cuero
- Doméstica
- Detergentes (amilasa, lipasas, proteasas)
- Limpiador de lentes de contacto
- Medicina
- Diagnóstico de alteraciones.
- Ensayos de análisis de diversas sustancias.
- Terapia (fibrinolíticos,...)
Nomenclatura y clasificación EC
II. Modo de acción de las enzimas
A. Interacción de la enzima con el sustrato (o los sustratos)
Terminología: sustratos, productos. Reacción.
La enzima aporta a la reacción:
velocidad especificidad control regulatorio.
La reacción catalizada por la enzima:
- Unión del sustrato (o los sustratos) S + E
 ES
ES
- Conversión de sustratos en productos ES
 EP
EP
- Liberación de los productos EP
 E + P
E + P
Sitio de unión y sitio activo:
 animaciones (simples pero ilustrativas, recomiendo nº 1, 2 y 3 )
animaciones (simples pero ilustrativas, recomiendo nº 1, 2 y 3 )
- La enzima facilita el contacto y orientación de los sustratos
- Los sustratos deben contactar (colisionar) con suficiente energía y con la orientación adecuada
- La interacción de la enzima con los sustratos lo facilita:
- “bolsillo de unión”, “centro de fijación del sustrato”
- Múltiples contactos (3D) de los residuos aminoácidos o nucleótidos de la enzima
- Enlaces no covalentes (“débiles”)
- La enzima diferencia entre estereoisómeros
- La enzima reduce la movilidad de los sustratos
- La enzima interviene en la transformación S
 P
P
- “centro activo”, “centro catalítico”, “sitio activo”
- Región de la enzima donde se unen los sustratos y donde se realiza la catálisis.
- Habitualmente es una parte no muy grande de la enzima completa.
- Es un bolsillo o hendidura tridimensional:
- múltiples puntos de interacción,
- entre los residuos de aminoácidos/nucleótidos (de diferentes partes de la estructura primaria)
- y los sustratos;
- interacciones no covalentes
- aporta estereoespecificidad
- Se genera un microambiente específico, adecuado para facilitar la reacción.
- Modelos para la unión entre enzima y sustrato:
- Modelo inicial: de “llave y cerradura”
- Modelo mejorado: de “ajuste inducido” o "adaptación inducida"
- ejemplo:
 Cambio conformacional de la hexoquinasa
Cambio conformacional de la hexoquinasa
- ejemplo:
 Cambios conformacionales durante una reacción enzimática�
Cambios conformacionales durante una reacción enzimática�
Complejo del estado de transición:
- Perfil de energía de las moléculas (S y P) a lo largo de la reacción
- Terminología: estado de transición; variaciones de energía libre; energía de activación
- Relación entre velocidad de la reacción y energía de activación.
B. Mecanismos moleculares de catálisis
Ilustrados con el ejemplo de la quimotripsina
Reacción de la quimotripsina. Intermediario oxianión tetraédrico.
Mecanismo de la catálisis
- Tríada catalíca Asp, His, Ser
- Catálisis ácido-base.
- Intermediario covalente unido a a enzima: Catálisis covalente.
 Mecanismo catalítico de la quimotripsina y en
Mecanismo catalítico de la quimotripsina y en  otra versión con más detalle (narrada en inglés)
otra versión con más detalle (narrada en inglés)
Resumen: conceptos clave del mecanismo:
- El entorno formado por los residuos aminoácidos del centro activo facilita el ataque (grupo hidroxilo de Ser desprotonado)
- Catálisis ácido-base: varios residuos del centro activo toman y ceden H+ en varios momentos de la reacción.
- Las concentraciones fisiológicas de H+ y OH− son bajas; la enzima puede aportar o aceptar H+
- Asp, Glu, His, Lys, Arg, (Ser, Cys, Tyr), Ade
- Catálisis covalente: intermediario unido a la E
- Grupos nucleófilos o electrófilos de la enzima (OH, SH, =O, NH2, >N, iones metálicos)
- Fijación y estabilización de los sustratos e intermedios: por ej., enlaces de H, interacciones iónicas, van der Waals, efecto hidrófobo
- El centro de unión del sustrato posee un “bolsillo hidrófobo” en el que encaja el residuo aminoácido del lado C del enlace peptídico, si es aromático (hidrófobo y voluminoso). Por ello, QT hidroliza preferentemente enlaces Xxx–Phe, Xxx–Tyr o Xxx–Trp (especificidad)
Otras contribuciones al mecanismo de catálisis enzimática:
- Interacciones electrostáticas
- Catálisis por iones metálicos : Fe2+, Fe3+, Cu2+, Mn2+, Co2+, Mg2+, Zn2+
- Estabilización del estado de transición
- Efectos entrópicos: La unión de los S al centro activo favorece su proximidad y orientación, reduce la entropía
La enzima reduce la energía de activación, produce un estado de transición más estable
- La implicación de la enzima introduce un “camino” diferente para conseguir la misma reacción.
- Los intermediarios y estados de transición son nuevos.
- La termodinámica de la reacción no cambia; cambia su cinética (velocidad)
III. Grupos funcionales en la catálisis
En las cadenas laterales de los residuos aminoácidos del sitio de unión y sitio activo; también grupos del esqueleto polipeptídico.
“Coenzimas”, moléculas no proteicas necesarias para la catálisis:
| cofactores |
| iones metálicos |
coenzimas |
| cosustratos |
grupos prostéticos |
| Fe, Mg, Zn, Co, Mn |
Se unen y se liberan reversiblemente.
Se modifican en la reacción
(se regeneran más tarde en otra reacción y enzima) |
Unidos permanentemente.
Se regeneran durante la reacción. |
Terminología: apoenzima y holoenzima.
Lectura opcional: "Aplicación clínica 10.3" - Enfermedad causada por la alteración del centro de unión de una coenzima.
Coenzimas que activan la transferencia de un grupo
Ilustrado con ejemplos:
| coenzima |
acción |
precursor |
| TPP, pirofosfato de tiamina |
transferencia de acetilo |
tiamina, vit. B1 |
| CoA, CoASH, coenzima A |
transferencia de acilo, formación de un tioéster de alta energía |
pantotenato, vit. B5 |
| biotina |
transferencia de CO2, carboxilación |
biotina, vit. B7, vit H |
| PLP, fosfato de piridoxal |
transferencia de grupo amino, transaminación |
piridoxina, vit. B6 |
Coenzimas de oxidorreducción, coenzimas redox
Ilustrado con ejemplos:
| coenzima |
acción |
precursor |
| NAD, dinucleótido de nicotinamida y adenina |
NAD + 2 H+ + 2 e−  NADH + H+ NADH + H+ |
niacina, vit B3, vit. PP |
| FAD, dinucleótido de flavina y adenina |
FAD + 2 H+ + 2 e−  FADH2 FADH2 |
riboflavina, vit. B2 |
Otras que se estudiarán más adelante: NADP, FMN
Iones metálicos como cofactores o coenzimas
- En 1/3 de las enzimas conocidas
- Contribuyen a fijar y orientar sustratos
- Estabilizan intermedios aniónicos
- Participan en reacciones redox
- Fe2+, Fe3+, Cu2+, Mn2+, Co2+, Mg2+, Zn2+
IV. Factores que afectan a la actividad enzimática
- Temperatura
- pH
- fuerza iónica
- inhibidores
- regulación biológica
Conceptos: T óptima, pH óptimo.
Causas:
- (des)protonación de grupos clave en el sitio activo
- alteración de interacciones E-S
- cambios conformacionales
- pérdida total de estructura (desnaturalización)
V. Inhibidores de la actividad enzimática basados en el mecanismo
(Interfieren en alguna etapa del mecanismo de la reacción catalizada)
Lectura opcional: "Aplicación clínica 10.5" - Un caso de envenenamiento por plaguicidas.
- Inhibidores covalentes
- Reacción irreversible con un estado intermedio
- Por ej.: los que reaccionan con la enzima formando un enlace covalente, en un residuo del centro catalítico.
- También los que establezcan una unión muy estable, aun no covalente
- La enzima ya no puede actuar
- Ejemplos: diisopropilfluorofosfato, ácido acetilsalicílico
- Análogos del estado de transición o de intermediarios
- Es más potente un análogo del ET que uno del S
- Ejemplos: penicilina, alopurinol
- Inhibición por metales pesados
- Hg2+ , Pb2+ , Al3+ , Fe3+
- Toxicidad
- Bastante inespecíficos
- Unión a grupos funcionales del centro activo:
-SH
 Hg2+
Hg2+
- Reemplazo del catión fisiológico:
Ca2+ , Fe2+ , Zn2+
 Pb2+
Pb2+
VI. Regulación de la actividad de las enzimas
[Este apartado no está explícitamente en el libro de Marks, pero es necesario para comprender lo que sigue.]
Actividad enzimática - definición
- ¿Cómo medimos actividad enzimática?
- reacción con sustrato sintético o “artificial”
- para poder detectar y cuantificar el sustrato o el producto
- ejemplos...
- AE es una medida de la cantidad de enzima y de su eficacia (si hubiese algo que la altere)
- Definiciones
- Actividad enzimática, AE
- Cantidad de sustrato convertido en producto por unidad de tiempo. Ej: UI , U (=µmol/min) , kat (=mol/s)
- Medida de la cantidad de enzima (por su eficacia, no por su masa)
- Concentración de actividad enzimática, [AE]
- Medida de la concentración de enzima. Ej: µmol L−1 min−1 , kat/L
- Actividad enzimática específica, AEE
- Actividad por unidad de masa (de enzima o de proteínas totales)
- Medida de la pureza o enriquecimiento de la enzima
 Ejercicios para afianzar los conceptos de actividad enzimática, concentración de actividad enzimática y actividad enzimática específica.
Ejercicios para afianzar los conceptos de actividad enzimática, concentración de actividad enzimática y actividad enzimática específica.
Velocidad de reacción - definición
- Velocidad de formación de los productos
- Aumento de la concentración de productos
- Disminución de la concentración de reactivos
- ѵ = d[P] / dt = −d[A] / dt
- Equivale a la [AE]
Reversibilidad
Progreso de la reacción: ¿cuándo debemos medir la velocidad?
Concepto de velocidad inicial
VII. Regulación por concentración de sustrato y de producto
Regulación por compuestos que se unen al centro activo reversiblemente. Iincluye: [S], [P], inhibidores reversibles.
Dependencia de la concentración de sustrato
"estudio cinético” de las enzimas
- Definición: Se estudia la velocidad de la reacción catalizada con distintas concentraciones de sustrato.
- Diseño del experimento: concentración de enzima constante (así como de cofactores, pH, T, sales...) Ayuda:

ѵ frente a [S]: saturación, curva hiperbólica.
Modelo de Michaelis y Menten
- Hipótesis y aproximaciones.
- Ecuación
- Interpretación de la ecuación y de sus parámetros.
- Significados de Km :
- Cociente de constantes de velocidad.
- ~ 1/ afinidad de E por S
- [S] que proporciona ½ѵmáx.
- La mitad de los sitios activos están ocupados por S.
- Significados de ѵmáx :
- Todos los sitios activos están ocupados con S
- E saturada con S
- E trabajando a plena capacidad
- [S] >>> Km
 Exploración de la variación de Km y vmáx
Exploración de la variación de Km y vmáx - Ajuste directo de los datos experimentales mediante regresión no lineal a la ecuación. Por ej.,
 https://bit.ly/regresionMM
y para el móvil:
https://bit.ly/regresionMM
y para el móvil:  biomodel.uah.es/m
biomodel.uah.es/m
- Linealización de la ecuación: Lineweaver y Burk, y otras

Efecto fisiológico del valor de Km : sensibilidad (con ejemplos)
Dependencia de la concentración de enzima
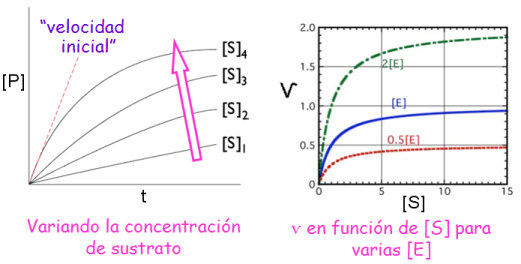 ¿Cómo será la gráfica de Ѵ frente a [E]? Ayuda:
¿Cómo será la gráfica de Ѵ frente a [E]? Ayuda: 
Ѵmáx depende de la concentración de enzima
kcat = ѵmáx / cE :: Constante catalítica
kcat = k3 en mecanismos sencillos como M-M
o nº de recambio = nº de moléculas S que cada sitio activo convierte en P por unidad de tiempo
Constante catalítica = nº de recambio.
Regulación de la �actividad enzimática mediante inhibidores reversibles
Tipos de inhibidores y efecto en la cinética
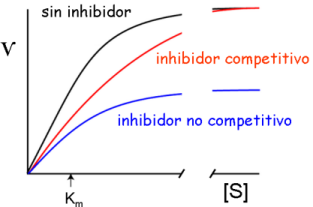
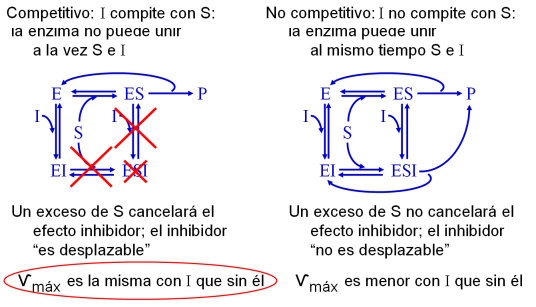
- Inhibidor competitivo
- habitualmente análogos estructurales del S (o del ET)
- No modifica Ѵmáx (puede desplazarse si aumenta S)
- Aumenta Km aparente
- Inhibidor no competitivo
- No hay interacción entre la unión de S y de I; I se une igual a E que a ES
- Reduce Ѵmáx (no es posible desplazarlo)
- No altera Km .
- Situaciones mixtas
- I se une en sitio distinto pero altera la unión de S, o I sólo se une a ES
- Se modifica tanto Ѵmáx como Km .
- “acompetitivo”, “incompetitivo”, “anticompetitivo” (No entraremos en estas distinciones)
Inhibición por producto
- Todos los P pueden tener efecto inhibidor, normalmente competitivo
- La inhibición cuando se acumula un producto (no se usa en reacciones subsiguientes de las rutas metabólicas) cumple función reguladora (retroinhibición) y economiza energía
VIII. Regulación de la actividad por cambios conformacionales de la enzima
Alostería
No insistiremos en:
- Efectos homotrópicos // Efectos heterotrópicos
- Modelo concertado // Modelo secuencial
Regulación alostérica. Enzimas alostéricas. Proteínas alostéricas.
¿Qué es? Alostería: del griego ἄλλως , allos: otro, y στερεός , stereós: forma
2 interpretaciones válidas y complementarias :
- alostería = otra forma = distintas conformaciones de la enzima que tienen distinta actividad enzimática
- alostería = otro sitio = un ligando (efector) que se une en lugar diferente al sitio activo (donde se une el sustrato) conduciendo a una actividad enzimática alterada
 Efectores, ligandos alostéricos:
Efectores, ligandos alostéricos:
- modulan la actividad de la enzima
- no sufren transformación
- positivos (activadores) o negativos (inhibidores)
- típicamente moléculas pequeñas (metabolitos), pero pueden ser proteínas
Definición: la unión de un ligando en un sitio distinto al sitio activo altera la actividad de la enzima debido a que provoca un cambio conformacional en la enzima.

 Ilustración ampliada, con ejemplos en 3D
Ilustración ampliada, con ejemplos en 3D
Cinética de enzimas alostéricas:
- En la situación más frecuente, las enzimas alostéricas no se comportan según el modelo de Michaelis y Menten, sino que presentan curvas de cinética sigmoides.
- Los efectores positivos y negativos desplazan la curva. ¿En qué sentido?
- La enzima está en equilibrio entre 2 conformaciones (R,T)
El efector positivo, activador, favorece (estabiliza) la conformación R, “relajada”, con más afinidad por el sustrato, con más actividad.
El efector negativo, inhibidor, favorece (estabiliza) la conformación T, “tensa”, con menos afinidad por el sustrato, con menor actividad.
Cooperatividad (no debe confundirse con alostería; conceptos diferentes aunque pueden darse a la vez)
- Los cambios conformacionales son responsables tanto de los mecanismos de alostería como de los de cooperatividad.
- Una proteína presenta cooperatividad cuando la afinidad de un sitio que une ligando depende del estado de ocupación del resto de sitios de unión.
- =Una proteína presenta cooperatividad cuando la ocupación de un sitio que une ligando modifica la afinidad del resto de sitios de unión.
- La unión cooperativa se identifica porque genera curvas sigmoides para la función de saturación.
- La cooperatividad es uno de los fenómenos que pueden presentar las proteínas alostéricas, proteínas con sitios de unión para ligandos diferentes y cuyas subunidades, además, interaccionan entre sí.
- La cooperatividad puede ser
- negativa: cuando la unión de una molécula de ligando disminuye la afinidad del resto de los sitios
- positiva (que es el caso más frecuente): cuando la unión de una molécula de ligando aumenta la afinidad de los sitios desocupados
Regulación por modificación covalente
(con cambio conformacional)
- Acetilación
- ADP-ribosilación
- Unión de lípidos
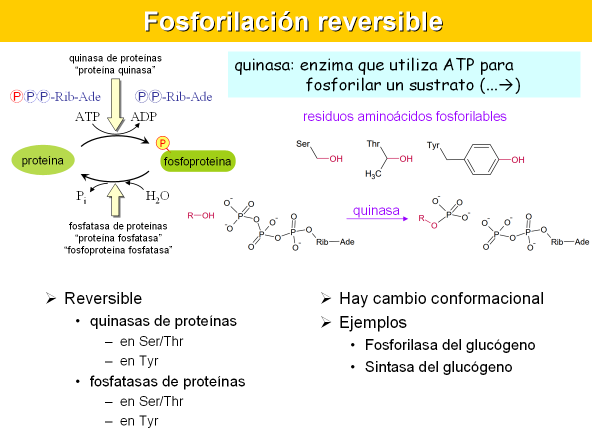
- Fosforilación reversible – Lo más frecuente
- Fosforilación y desfosforilacíón de residuos aminoácidos de la enzima.
- Cambios conformacionales y de afinidad por sus sustratos o de capacidad catalítica.
- Residuos aminoácidos fosforilables: los grupos alcohol: Ser, Thr, Tyr
- Enzimas responsables: quinasas de proteínas y fosfatasas de proteínas
Reacciones de fosforilación y desfosforilación de una proteína. Concepto de quinasa y fosforilasa.
Adicional como refuerzo: importante
También en 

Ejemplo: quinasa de la glucógeno-fosforilasa.
Regulación por interacción entre proteínas
Regulación de la actividad enzimática debida a cambio conformacional, debido a su vez a la interacción de la enzima con otra proteína.
Ejemplo: activación de la proteína quinasa A por unión de AMP cíclico.
No estudiaremos:
Calmodulina–Ca2+ ni Proteínas G monoméricas o pequeñas, p.155 de Marks
Activación por ruptura proteolítica
Zimógenos o proenzimas.
Ejemplos:
- Proteasas digestivas: tripsinógeno, quimotripsinógeno, pepsinógeno. [ilustrado adicionalmente en
 ]
]
- Otros ejemplos (no estudiamos detalles aquí): factores de coagulación (proteasas)
V. Regulación de las rutas metabólicas
- Rutas o vías = secuencias de reacciones sucesivas.
- Velocidad de la ruta = velocidad de la etapa más lenta (etapa limitante)
- Habitualmente, la enzima de la 1ª etapa es la que sufre regulación (enzima reguladora de la ruta)
- Frecuentemente, los productos finales de la ruta son reguladores negativos (retroinhibición)
Isoenzimas
Isoformas o variantes de una enzima.
Formas alternativas de la proteína, variantes, con alguna diferencia en su estructura y actividad:
- codificadas en genes separados
- secuencia de aminoácidos
- parámetros cinéticos
- sensibilidad a la regulación
- “preferencia” por sustratos
Resultan adecuadas para situaciones o entornos diferentes; p.ej. en distintos tejidos, especialización metabólica.
Aplicación diagnóstica (detección de isoenzimas en plasma procedentes de daño en tejidos. Ejemplos:
Lactato deshidrogenasa (LDH)
Creatina quinasa (CK)
Ejemplo: Lactato deshidrogenasa (LDH) 
-fin-
animaciones (simples pero ilustrativas, recomiendo nº 1, 2 y 3 )
Ejercicios para afianzar los conceptos de actividad enzimática, concentración de actividad enzimática y actividad enzimática específica.
 biomodel.uah.es/m
biomodel.uah.es/m ¿Cómo será la gráfica de Ѵ frente a [E]? Ayuda:
¿Cómo será la gráfica de Ѵ frente a [E]? Ayuda: ![]()
Efectores, ligandos alostéricos:
![]() Ilustración ampliada, con ejemplos en 3D
Ilustración ampliada, con ejemplos en 3D ![]()


![]()