Tema 17 - Lipólisis y oxidación de ácidos grasos
+ Tema 18 - Lipogénesis y biosíntesis de ácidos grasos
- Catabolismo de los ácidos grasos
- Activación y entrada de ácidos grasos a la mitocondria.
- Beta-oxidación de los ácidos grasos: reacciones, balance energético y regulación.
- Casos especiales: nº C impar e insaturados
- Biosíntesis de ácidos grasos
- Ác.grasos saturados, nº C par (palmitato): sintasa de ác.grasos.
- Regulación.
- Biosintesis de otros AG. Familias omega.
- Metabolismo de los cuerpos cetónicos
- Digestión, absorción y transporte de los lípidos
- Lipoproteínas
- Metabolismo de triacilgliceroles
- Catabolismo (lipólisis) y biosíntesis (lipogénesis)
Catabolismo de los ácidos grasos
- Transporte hasta los tejidos
- Captación por las células
- Transporte intracelular
- Activación con CoA
- Entrada a la mitocondria (lanzadera de carnitina)
- Fragmentación: oxidación a acetilos (“β-oxidación”)
Transporte y captación de ácidos grasos
- En sangre: unidos a albúmina
- Captación por los tejidos: proteína de membrana, ligado a transporte activo de Na+
- Depende del tejido
- cerebro y eritrocitos: no
- músculo cardiaco: sí, esencial
- Desde membrana hacia mitocondria, RE,... unidos a proteínas ligantes
- Degradación: en mitocondrias y peroxisomas: proceso de “beta-oxidación”
1ª etapa previa a la degradación: activación de los ácidos grasos
En el citosol el carboxilo se “activa” como tioéster acil-CoA
acil-CoA sintetasa en la membrana mitocondrial externa == para degradación de ácidos grasos
acil-CoA sintetasa en la membrana del retículo endoplásmico == para biosíntesis de lípidos
Activación mediante la acil-CoA sintetasa
- Reacción en el citosol, enzima asociada a la membrana mitocondrial externa 13-7
- ATP + ácido graso ➜ PPi + [acil-AMP]
- [acil-AMP] + CoA ➜ acil-CoA + AMP
- gasto: 2 ATP
2ª etapa previa a la degradación: transporte a la matriz mitocondrial
Lanzadera de carnitina para los acil-CoA. 13-8
Fragmentación: oxidación a acetilos (“β-oxidación”)
¿Qué sucede después en la mitocondria? Resumen:
- un grupo CH2 (en beta) pasa a ser carboxilo :: β-oxidación
- se producen equivalentes de reducción, NADH (2 por cada iteración)
- se producen (n/2) unidades de acetil-CoA ➜ (c.Krebs) ➜ más NADH y FADH2
Comparación:
Degradación de ácidos grasos:
- Escisión secuencial de fragmentos de 2 C, en forma de acetil-CoA
- Desde el extremo carboxilo
- Siempre (activado) en forma de tioéster
- Se oxida el Cβ
- En mitocondrias principalmente
- Hay otros mecanismos especiales
|
Biosíntesis de ácidos grasos:
- Adición secuencial de fragmentos de 2 C a partir de un precursor de 3C, el malonil-CoA
- Por el extremo carboxilo
- Siempre (activado) en forma de tioéster
- Se reduce el Cβ
- En el citosol (especialmente hígado)
|
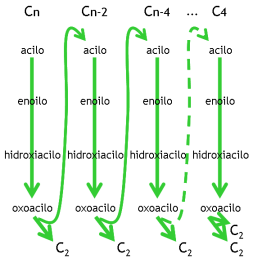
13-9 Detalle de las 4 reacciones en cada iteración (de Cn a Cn-2)
y ruta en Biomodel
1ª oxidación + hidratación + 2ª oxidación + ruptura

acilo
enoílo
hidroxiacilo
oxoacilo
|
 |
Balance de la β-oxidación:
Desde el acil-CoA:
- Cn ➜ (n/2)-1 iteraciones / repeticiones / rondas / “vueltas”
- cada iteración:
- FAD ➜ FADH2
- NAD ➜ NADH
- CoA ➜ acetil-CoA
- H2O ➜
- y en la última iteración:
- acetil-CoA, FADH2, NADH ➜ al ciclo de Krebs y fosforilación oxidativa
- n/2 acetilCoA
- (n/2 −1) FADH2 ➜ …..... ATP
- (n/2 −1) NADH ➜ ........ ATP
- Ecuación ajustada: …………
|
Desde el ácido graso:
- ácido graso + 2 ATP ➜ acil-CoA + 2ADP + 2 Pi
- Balance total: (....... −2) ATP
- Ecuación ajustada: …………
|
La degradación de AG se regula por la propia disponibilidad de éstos, que depende de la regulación hormonal de la movilización de las grasas desde el tejido adiposo.
Degradación de otros ácidos grasos
- con nº impar de C
- insaturados
- ramificados
Biosíntesis de los ácidos grasos
Saturados, de nº par de C. Modelo: palmitato, que es el producto mayoritario de la enzima sintasa de ácidos grasos.
¿Dónde? principalmente en hígado
¿Cuándo? pocas grasas en alimentos; muchos carbohidratos o proteínas en alimentos
¿Cómo? a partir de glucosa ➜ acetil-CoA ➜ ácidos grasos
¿Dónde? (ubicación subcelular) AcCoA en matriz mitocondrial, síntesis en citosol
Resumen de la ruta de biosíntesis (esquema de la ruta en Biomodel)
- Preparación del sustrato
- Unión a la enzima
- Reacciones de elongación
- Balance de C y de energía
El acetil-CoA se genera en la mitocondria y para la síntesis de ácidos grasos es preciso que salga: lo hace en forma de citrato (lanzadera de acetil-CoA)
Comparación entre biosíntesis y degradación de AG: 4 etapas, tipos de reacción, metabolitos intermediarios, enzimas
Degradación de ácidos grasos:
- Escisión secuencial de fragmentos de 2 C, en forma de acetil-CoA
- Desde el extremo carboxilo
- Siempre (activado) en forma de tioéster
- Se oxida el Cβ
- En mitocondrias principalmente
- Hay otros mecanismos especiales
|
Biosíntesis de ácidos grasos:
- Adición secuencial de fragmentos de 2 C a partir de un precursor de 3C, el malonil-CoA
- Por el extremo carboxilo
- Siempre (activado) en forma de tioéster
- Se reduce el Cβ
- En el citosol (especialmente hígado)
|
- Utiliza FAD y NAD como coenzimas redox
- En todo momento, tioéster con CoA
|
- Utiliza NADP como coenzima redox
- En todo momento, tioéster con la enzima
|
 en la biosíntesis, en sentido contrario: reducción del Cβ
en la biosíntesis, en sentido contrario: reducción del Cβ
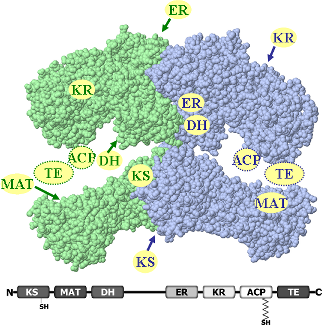
Sintasa de ácidos grasos
Estructura, en mamíferos: Fig. 12-19
- Homodímero. Cada subunidad es una sola cadena polipeptídica que contiene los 6 centros activos y el brazo portador ACP (intermediarios unidos covalentemente a la enzima).
- Con varios centros catalíticos:
- malonil/acetiltransferasa (MAT)
- cetoacil sintasa (KS)
- cetoacil reductasa (KR)
- deshidratasa (DH)
- enoil reductasa (ER)
- tioesterasa (TE)
- y además
proteína portadora de acilos (ACP)
En otros organismos, distinta estructura pero mismas actividades catalíticas y mecanismo análogo:
- bacterias y plantas: 7 actividades en 7 cadenas polipeptídicas separadas
- levaduras: 7 actividades en 2 cadenas polipeptídicas
- vertebrados: 7 actividades en una sola cadena polipeptídica
- En todos, actuación secuencial (animación 1 y animación 2) de las 6 actividades enzimáticas y transferencia de los intermediarios mediante la ACP.
Proteína portadora de acilos:
- Es una parte de la sintasa; 77 residuos aminoácidos, unos 88 kDa
- Grupo prostético 4'-fosfopanteteinilo (deriva del CoA)
- Puede aproximar la cadena acilo a todos los centros catalíticos.


Reacciones y actividades enzimáticas:
5 actividades enzimáticas repetitivas (una de ellas también iniciadora) y una final. Fig. 12.15
y además la proteína portadora del acilo (ACP)
- (1a) Actividad malonil/acetil transferasa, MAT, también: malonil/acetil transacilasa
- Prepara el acetil-CoA, queda unido a la enzima (tioéster)
- luego lo pasa a la KS = cetoacil-sintasa (tioéster)
- (1b) Actividad malonil/acetil transferasa, MAT, también: malonil/acetil transacilasa
- Prepara también el malonil-CoA, queda unido a la enzima (tioéster)
- (2) Actividad cetoacil-sintasa, KS, también: “enzima condensante”
- tomó el acetilo de la ACP
- y lo hace reaccionar con el malonilo
- Se ha formado el 2-cetoacilo
- Se puede considerar que la descarboxilación impulsa la reacción, por eso es preciso el malonilo
- (3) Actividad cetoacil-reductasa, KR
- de 2-cetoacilo a 2-hidroxiacilo: (isómero D-, no L-)
- (4) Actividad deshidratasa, DH
- de 2-hidroxiacilo a Δ2-enoílo
- (5) Actividad enoil-reductasa, ER
- (6=2) Actividad cetoacil-sintasa
- Toma el acilo y lo hace reaccionar con un nuevo malonilo preparado por la transferasa.
- (7) Actividad tioesterasa (específica para C16 ; por ello, palmitato es el producto)
Iteración y balance:
- Cn ➜ (n/2)-1 iteraciones / repeticiones / rondas / “vueltas”
- Primera: acetil-CoA ➜ CoA
- Cada iteración:
- malonil-CoA ➜ CoA + CO2
- 2 NADPH + 2 H+ ➜ 2 NADP+
- ➜ H2O
- última: ➜ (n)acil-S-enzima
- Final: actividad tioesterasa
Obtención del malonil-CoA

acetil-CoA + CO2 + ATP ➜ ADP + Pi + malonil-CoA (energía almacenada en el malonilo, forma activada del acetilo )
acetil-CoA carboxilasa; es la etapa limitante de la síntesis de AG y la reguladora
3 actividades componentes: proteína portadora de biotina + biotina carboxilasa + transcarboxilasa
En bacterias: 3 subunidades; en mamíferos y aves: una sola cadena con 2346 residuos aminoácidos
Para el balance:
- malonil-CoA ➜ CoA + CO2
acetil-CoA + CO2 + ATP ➜ malonil-CoA + ADP + Pi
suma: acetil-CoA + ATP ➜ CoA + ADP + Pi
- Nueva ecuación ajustada: …………
Intenta calcular el balance para la síntesis de palmitato a partir de acetil-CoA antes de comprobar la respuesta

Regulación de la síntesis de palmitato
En eucariotas, a través de la actividad de la acetil-CoA carboxilasa.
- La ACC es un dímero, sin actividad enzimática significativa.
- La ACC puede polimerizar en grandes filamentos (de 4 a 8 MDa) y entonces adquiere actividad enzimática. Fig. 12.18
- La polimerización se regula:
- alostéricamente (citrato [+], malonil-CoA [−], palmitoil-CoA [−])
- por modificación covalente (fosforilación reversible) en respuesta a hormonas
Regulación:
- Elevación de citrato en citosol ➜ polimerización de la ACC (filamentos de 4 a 8 MDa) ➜ activación ➜ síntesis
- Elevación de malonil-CoA o palmitoil-CoA ➜ despolimerización de la ACC ➜ inactivación ➜ no hay síntesis
- AMPK = proteína quinasa dependiente de AMP; activada por AMP, inactivada por ATP. Fosforila la ACC.
- Palmitoil-CoA ➜ inhibe la translocasa que saca citrato de la mitocondria al citosol
- Malonil-CoA ➜ inhibe la carnitina aciltransferasa I (lanzadera) ➜ evita entrada de AG a la mitocondria
- Control hormonal:
- glucagón o adrenalina ➜...➜ fosforilación de ACC ➜ despolimerización e inactivación (ayuno, ejercicio)
- insulina ➜ desfosforilación de ACC ➜ polimerización y activación
- insulina ➜ activa la citrato liasa (citrato ➜ acetilCoA)
Biosíntesis de otros ácidos grasos
La sintasa de ácidos grasos (citosol) produce palmitato. A partir de él se sintetizan otros.
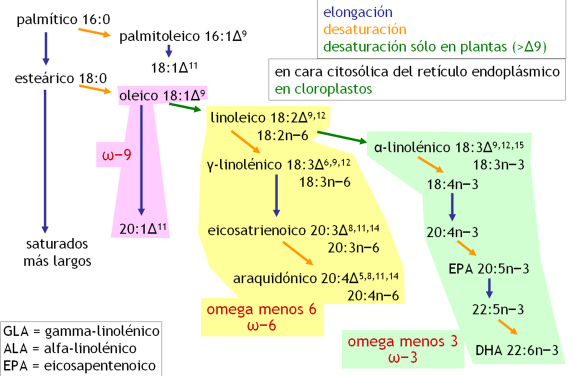
Elongación a C>16: enzimas asociadas a la cara citosólica de la membrana del RE; mecanismo similar (malonil-CoA)
Insaturados:
- enzimas en el RE (oxidasa, Δ9)
- en mamíferos no hay desaturasas capaces de actuar más allá del C9
- en plantas hay desaturasas Δ12 y Δ15
- razón de ácidos grasos “esenciales”
- las desaturaciones se combinan con elongaciones, generando las “series” o “familias omega” de ácidos grasos (origen biosintético)
Todos los ácidos grasos se usan para sintetizar:
- Lípidos saponificables
- Triacilgliceroles
- Fosfoacilgliceroles
- Fosfoesfingolípidos
- Fosfolípidos de membrana (su fluidez depende de insaturados)
- Ceras
- Moléculas señal (eicosanoides: prostaglandinas, tromboxanos, leucotrienos).
¿Qué sabemos de los ácidos grasos “omega”?
- Nombre
- Estructura química
- Metabolismo
- Actividad biológica
Cuerpos cetónicos
Identidad: acetona, acetoacetato, D-β-hidroxibutirato
Destinos del acetil-CoA:
- ciclo de Krebs
- síntesis isoprenoides
- síntesis ác. grasos (y lipogénesis)
Productos de un exceso de acetil-CoA: cuerpos cetónicos :: “cetogénesis” :: En la matriz mitocondrial, en especial hepatocitos
Los animales no pueden convertir AcCoA en glucosa
Pueden ser utilizados como fuente de energía por músculo cardiaco, músculo esquelético y otros tejidos. Combustible alternativo a la glucosa. Incluso cerebro en casos extremos de carencia de glucosa
Si se acumulan en sangre: “cetosis” [ayuno prolongado, diabetes no controlada] Aporte deficitario de carbohidratos ➜ lipólisis, para obtener energía ➜ cuerpos cetónicos ➜ cetosis
Si algún problema metabólico (diabetes de tipo 1) impide degradar estos cuerpos cetónicos ➜ cetoacidosis (acidosis por cuerpos cetónicos). La cetoacidosis es un estado metabólico peligroso que puede desencadenar diversos problemas de salud, incluso fallos severos en el organismo.
Reacciones de formación de cuerpos cetónicos; 13-13; ruta en Biomodel
Catabolismo de los cuerpos cetónicos; 13-14
Formación y exportación de cuerpos cetónicos:
- (En hígado)
- En situaciones donde se promueve la gluconeogénesis (diabetes no tratada, inanición)
ésta utiliza el oxalacetato: escasea, se frena el ciclo de Krebs
- Exceso de acetil-CoA: se convierte a acetoacetato
- El CoA liberado permite continuar con la β-oxidación.
- El exceso de acetoacetato y otros cuerpos cetónicos se exporta a la circulación, y se puede generar un cuadro de cetosis.
- Acetoacetato e hidroxibutirato se exportan a corazón, músculo esquelético, riñón y cerebro, donde se emplean como fuente de energía
- La glucosa se exporta a cerebro y otros tejidos, donde se emplea como fuente de energía
Digestión, absorción y transporte de lípidos
Digestión
- intestino delgado
- en la interfaz lípido-agua
- micelas
- asistida por movimientos peristálticos
- asistida por sales biliares (acción detergente)
- triacilglicerol lipasa secretada por el páncreas: TAG ➜ 1,2-DAG ➜ 2-MAG + sales de AG nº 1 y 3 (Na+, K+)
- fosfolipasa A2 secretada por el páncreas FL ➜ lisofosfolípidos (1-acil-3-fosfo) + sales de AG nº 2 (Na+, K+)
- ** fosfolipasas A2 en veneno de serpientes y de abeja
- colesterol esterasa secretada por el páncreas (como zimógeno): ésteres de colesterol ➜ colesterol + AG
Absorción
- se absorben sólo moléculas anfipáticas
- mezcla resultante: AG + MAG + DAG + lisoFL; se absorben en la mucosa intestinal, requiere sales biliares
- en el citosol de la célula de la mucosa: proteína intestinal ligante de ácidos grasos, I-FABP
- se convierten a TAG (de nuevo) dentro del enterocito
Transporte
Importante: solubilidad
Lípidos exógenos
Mucosa (enterocito): lípidos (TAG + Col + FL) + prot ➜ quilomicrones (un tipo de lipoproteínas) ➜ sistema linfático ➜ sangre
Los quilomicrones salen de los enterocitos por exocitosis y pasan a los vasos quilíferos (capilares linfáticos). Cuando se están absorbiendo grandes cantidades de lípidos, la linfa que parte del intestino delgado tiene un aspecto lechoso y pueden verse fácilmente esos capilares. De ahí la linfa pasa a los nodos linfáticos mesentéricos (LN) y luego a vasos linfáticos mayores. Finalmente el contenido se vierte al sistema venoso.
Esquemas de la absorción intestinal de lípidos: 13-3, 12.1 y éstos:
 |
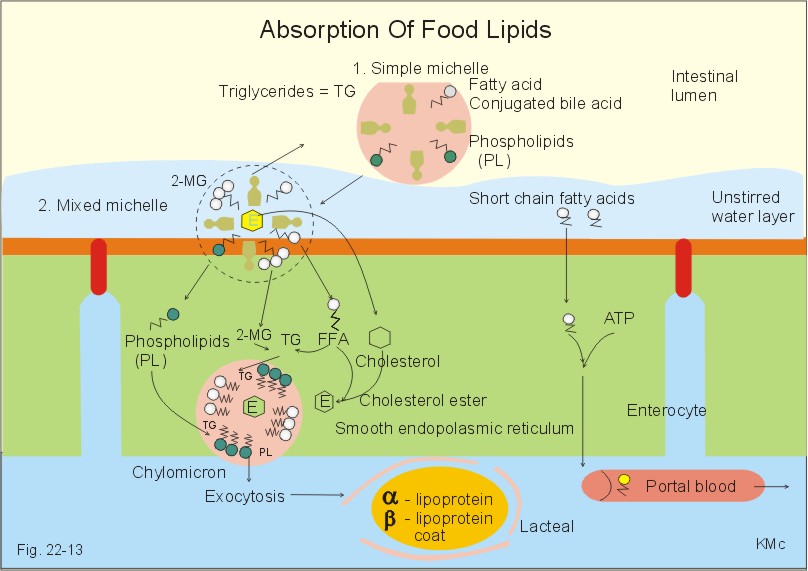
New Human Physiology 2nd ed., Chap. 22. P.E. Paulev & G. Zubieta-Calleja
|
Lípidos endógenos
Hígado: lípidos (TAG) endógenos ➜ VLDL (“lipoproteínas de densidad muy baja”) ➜ sangre
Importante: solubilidad
Entrada a tejidos
Capilares en adiposo y muscular: lipoproteína lipasa: TAG ➜ glicerol + AG
Lipoproteínas
Asociación de muchas moléculas
Interior: lípidos poco polares
Exterior: lípidos polares y proteínas, “apolipoproteínas” apoA-I, apoA-II, apoA-IV, apoB-48, apoB-100, apoC-I, apoC-II, apoC-III, apoD, apoE
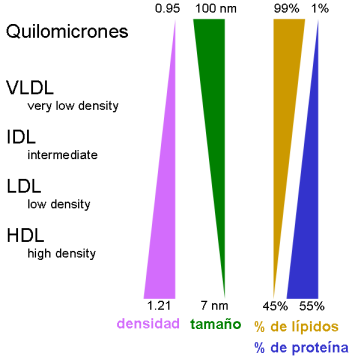
Diferente composición y propiedades (densidad, tamaño, movilidad electroforética)
Separación: por ultracentrifugación o por electroforesis
Diferente función: 13-5 Tabla 13-2
QM:
1. Desde los alimentos.
Al sistema linfático.
A los capilares sanguíneos en tejidos periféricos.
2. Hidrólisis de TAG y captación de AG y glicerol.
Adipocitos y miocitos.
Almacén de TAG.
3. QM remanentes captados por hígado.
VLDL:
1. Se forman en hígado. (TAG endógenos)
2. Por sangre a tejidos.
3. Hidrólisis de TAG y captación de AG y glicerol ➜ VLDL remanentes = IDL
IDL:
1. Por sangre, captadas por el hígado.
2. En sangre pueden captar más colesterol ➜ LDL
LDL:
1. Por sangre, captadas por otros tejidos. Receptor y endocitosis.
HDL:
1. Se forman en hígado.
2. A sangre.
3. Captan colesterol de los tejidos.
4. Captadas por el hígado
Funcionalidad diferenciada de LDL y HDL con respecto al colesterol:
- LDL transportan colesterol hacia los tejidos
- HDL transportan colesterol hacia el hígado ➜ metabolismo o excreción
- Concentración de colesterol en plasma:
- colesterol total =
libre + esterificado;
siempre asociado a lipoproteínas ~~ peligroso si muy elevado
- colesterol en LDL [C-LDL] ~~ peligroso si muy elevado
- colesterol en HDL [C-HDL] ~~ no peligroso
Más detalles: receptores y enzimas
- Capilares tisulares: receptor de apoC-II (de QM y VLDL), activa la lipoproteína lipasa (LPL) plasmática: TAG ➜ AG + Gro para las células; resíntesis de TAG para almacén
- QM remanentes: al hígado, suministran Col, FL, AG, aa
- IDL: FL, Col y aa para el hígado
- Sangre: prot. transportadora de colesterol esterificado (CETP): más Col a las IDL
- Tejidos: receptor de apoB-100 (de LDL), endocitosis, suministro de FL, Col y aa
- Lecitina colesterol aciltransferasa (LCAT) esterifica el Col de HDL con AG de los FL de QM y VLDL
Metabolismo de los triacilgliceroles
- Catabolismo de los triacilgliceroles
- Biosíntesis de triacilgliceroles y otros lípidos (lipogénesis)
- Regulación hormonal
Catabolismo de los triacilgliceroles
13-6 y éste:
Regulación hormonal
Insulina:
- inactiva la TAG lipasa en adipocito (no se degradan TAG)
- (indirectamente) se estimula transporte de VLDL (desde hígado hacia adipocito)
- estimula la lipoproteína lipasa en adipocito (captación de AG)
- estimula glucólisis ➜ DHAP en adipocito ➜ Gro3P ➜ síntesis de TAG
Glucagón y adrenalina:
- activan la TAG lipasa en adipocito (la PKA fosforila la enzima)
Biosíntesis de triacilgliceroles y otros lípidos (lipogénesis)
Principalmente en células de hígado y de adiposo; en retículo endoplásmico liso.
Adiposo: síntesis para almacenar reservas y degradación en caso de necesidad.
Los ácidos grasos deben activarse con CoA y reaccionan con glicerol-3P
Lipogénesis = síntesis de grasas (= triacilgliceroles)
- A partir de
- lípidos: ác. grasos exógenos (de la dieta; TAG en quilomicrones)
- lípidos: ác. grasos endógenos (de biosíntesis; TAG en VLDL desde el hígado)
- glicerol
- A partir de
- glúcidos, a través de acetil-CoA o de DHAP
- aminoácidos
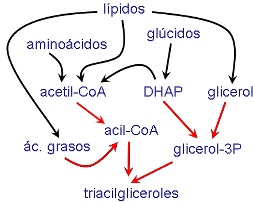
13-15 y 13-16 + 
El glicerol-3P es también precursor biosintético de otros tipos de lípidos.
-(fin)-




 en la biosíntesis, en sentido contrario: reducción del Cβ
en la biosíntesis, en sentido contrario: reducción del Cβ